Os programas de reabilitação respiratória (PRR) têm demonstrado em doentes com patologia pulmonar crónica, melhoria da capacidade de exercício e do estado de saúde e diminuição da dispneia e da utilização de recursos de saúde. Habitualmente, estes benefícios diminuem após conclusão dos programas.
ObjetivoAvaliar a capacidade funcional e o estado de saúde 2 anos após o término de um PRR.
MétodosEstudo retrospetivo de doentes que completaram um PRR. Após o PRR, os doentes que referiam ter adotado um estilo de vida fisicamente ativo foram incluídos no grupo ativo (GA). Os restantes doentes foram considerados como grupo controlo (GC). A capacidade funcional foi avaliada com a prova de marcha dos 6 minutos (PM6m) e o estado de saúde com o questionário de St. George na doença respiratória (SGRQ).
ResultadosForam incluídos 32 doentes, 24 no GA e 8 no GC. Imediatamente após o PRR observou-se, em ambos os grupos, uma melhoria significativa na PM6m e na pontuação total do SGRQ. Após o término do PRR, no GA, observou-se um declínio na distância média percorrida na PM6m aos 6 meses, 1 ano e 2 anos, bem como no estado de saúde.
Contudo, 2 anos após o PRR e comparando com os valores avaliados antes do início do PRR, o GA continuava a apresentar uma melhoria na distância percorrida na PM6m, em média de 32 m (p = 0,03) e de pelo menos 4 pontos no SGRQ. No GC observou-se um declínio clinicamente significativo na PM6m (−34 m) e no SGRQ (agravamento de 13 pontos).
ConclusãoEmbora se verifique uma perda progressiva dos benefícios do PRR após a sua cessação, estes ainda são significativamente positivos até 2 anos após o treino no GA. Um estilo de vida fisicamente ativo parece contribuir para manter os benefícios do Programa de Reabilitação.
Pulmonary rehabilitation programs (PRP) have been shown to improve exercise capacity and health status and to reduce dyspnoea and use of healthcare resources, in patients with chronic lung disease. These benefits usually wane after the programs conclusion.
AimEvaluate functional capacity and health status 2 years after the end of a PRP.
MethodsRetrospective study of patients who took part in PRP. After PRP, patients who reported a physically active lifestyle were included in the active group (AG). The other patients were considered as the control group (CG). Functional capacity was evaluated with 6minute walk distance (6MWD) and health status with St George's Respiratory Questionnaire (SGRQ).
ResultsThirty-two patients were included, 24 in the AG and 8 in the CG. Immediately after PRP, there was a significant improvement in the 6MWD and SGRQ global score, for both groups. After completing PRP, in the AG, there was a decline in the mean 6MWD when evaluated at 6 months, 1 and 2 years and also in health status.
However, after 2 years, the AG continued to show an average improvement of 32 m (p=0.03) in the 6MWD and at least 4 points in SGRQ compared to pre-PRP, while in the CG, there was a clinically significant decline in 6MWD (−34 m) and SGRQ score (13 points worse).
ConclusionDespite the progressive decline of benefits gained after completing PRP, in the AG these are still significantly positive after 2 years. An active lifestyle seems to help maintain the benefits of the Rehabilitation Program.
Existe uma forte evidência científica documentando a eficácia dos programas de reabilitação respiratória (PRR) em doentes com doença pulmonar crónica, em particular com DPOC1–5.
Os PRR com uma duração de pelo menos 8 semanas de treino de exercício têm demonstrado melhorar a capacidade de exercício, o estado de saúde, a dispneia e reduzir a utilização de cuidados de saúde6,7. Após a fase intensiva do programa, estes benefícios tendem a diminuir7.
Tendo em consideração o princípio da reversibilidade, após conclusão do treino de exercício3,8 é necessário implementar estratégias para manter os benefícios do PRR, especialmente através da melhoria a longo prazo da capacidade de autogestão e aderência à prática de exercício no domicílio9.
Várias estratégias têm sido desenvolvidas para manter os benefícios do PRR, tais como chamadas telefónicas, grupos de apoio, visitas regulares ao centro de reabilitação, visitas domiciliárias regulares e monitores de atividade7,9,10. Contudo os resultados destas intervenções variam entre os estudos.
O objetivo deste estudo foi avaliar a capacidade funcional e o estado de saúde aos 6 meses, 1 ano e 2 anos após a conclusão de um PRR, em doentes seguidos regularmente num hospital de dia de insuficientes respiratórios e avaliar uma potencial relação entre a manutenção da atividade física e os resultados obtidos no follow up.
MétodosAmostraForam incluídos os doentes que participaram num programa de reabilitação respiratória no hospital de dia de insuficientes respiratórios do Hospital Pulido Valente, desde Setembro de 2005 a Fevereiro de 2010. Como critérios de inclusão os doentes deveriam ter completado o PRR e aceitar participar no programa de follow up.
Desenho do estudoOs programas de reabilitação tinham uma duração de pelo menos 12 semanas e eram compostos por treino de exercício (tapete ou bicicleta, 3 vezes por semana) com intensidade alvo de 80% da potência de pico atingida durante um teste de exercício incremental máximo, realizado previamente no mesmo ergómetro. A duração do programa era a necessária para o doente atingir a intensidade alvo de 80% da potência de pico. Alguns doentes tiveram uma progressão mais lenta, devido aos sintomas e alguns tiveram de interromper o programa por exacerbações, mas retomaram-no logo que possível.
A modalidade do treino foi adaptada à preferência do doente e de acordo com a probabilidade do doente manter este exercício após terminar o PRR.
Todos os doentes receberam sessões educacionais e estratégias de promoção de competências de autogestão e, se necessário, apoio psicológico e nutricional, bem como outros exercícios supervisionados (p. ex. exercícios respiratórios e treino dos membros superiores). Ao longo do programa, os doentes eram encorajados a adotar um estilo de vida ativo. Seis meses após o PRR, os doentes eram questionados sobre o seu nível de atividade física habitual. Se reportassem praticar exercício regularmente, de acordo com a prescrição (p. ex. pelo menos 30 minutos de caminhada ou exercício numa bicicleta estacionária, 3 vezes por semana) eram incluídos no grupo ativo (GA). Se pelo contrário voltassem a ser sedentários, eram considerados como grupo controlo (GC). Ambos os grupos eram incentivados, em cada visita semestral, a praticar exercício regularmente.
Os processos clínicos dos doentes que cumpriam os critérios de inclusão foram revistos e analisados os dados demográficos, hábitos tabágicos, doença pulmonar, comorbilidades (Índice de Charlson11–13), níveis de ansiedade e depressão (avaliados pela Hospital Anxiety and Depression Scale14), escala de dispneia do Medical Research Council (MRC)15, provas funcionais respiratórias, duração do PRR, intensidade alvo atingida durante o PRR, prova de marcha dos 6 minutos (PM6m)16 e o questionário de St. George na doença respiratória (SGRQ)17. A todos os doentes foi atribuído um código, a fim de manter a confidencialidade.
A PM6m foi realizada de acordo com as recomendações da American Thoracic Society16. Para superar o efeito de aprendizagem, a PM6m foi realizada inicialmente 3 vezes e a terceira foi considerada como a PM6m basal. O nosso protocolo incluía a realização da PM6m antes do PRR (basal), imediatamente após o PRR, aos 6 meses, 1 ano e 2 anos. Considerámos 25 metros como a distância mínima clinicamente significativa, como foi recentemente evidenciado por Holland et al.18
O SGRQ é um questionário estandardizado de autopreenchimento, utilizado para avaliar o estado de saúde em doentes com doença respiratória. Uma pontuação de zero indica o melhor resultado e cem, o pior17,19. O SGRQ foi realizado antes do PRR, imediatamente após o PRR, 1 ano e 2 anos após o PRR. Considerámos 4 pontos como a diferença mínima clinicamente significativa, de acordo com o autor Paul Jones19.
Análise estatísticaOs dados são apresentados como média ± desvio-padrão para as variáveis contínuas e como frequências e percentagens para as variáveis categóricas.
Todas as variáveis foram testadas para a distribuição normal através do histograma de frequência e os testes Kolmogorov-Smirnov ou Shapiro-Wilk. A diferença entre duas médias foi determinada utilizando o teste T-Student ou de Mann-Whitney, quando apropriado.
As proporções e variáveis categóricas foram analisadas com o teste do Qui-quadrado ou de Fisher, quando apropriado. Foi considerado um p estatisticamente significativo se inferior a 0,05.
A análise estatística foi realizada utilizando o software PASW (versão 18; SPSS Inc., Chicago, IL, EUA).
ResultadosForam incluídos no estudo 32 doentes, 84,4% do género masculino, com média etária de 66,8 ± 9,4 anos. A maior parte dos doentes eram ex-fumadores (90,6%) e tinham o diagnóstico de DPOC (81,2%). Dos doentes com DPOC houve um predomínio do estádio iv do GOLD (80,8%).
A duração média do PRR foi de 26 semanas e todos os doentes atingiram a intensidade alvo (80% da potência de pico, avaliada previamente). A maioria dos doentes treinou em tapete (65,6%) e 34,4% em cicloergómetro.
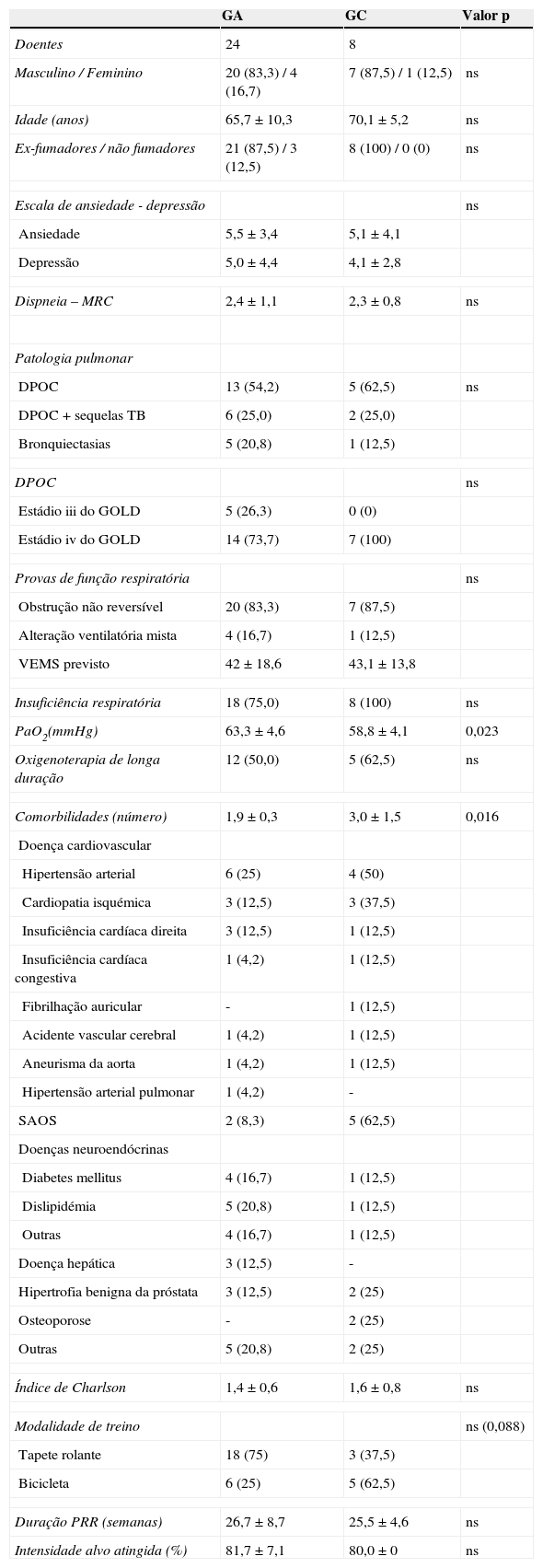
Foram incluídos 24 doentes no grupo ativo (GA) e 8 doentes no grupo controlo (GC). As características basais eram semelhantes entre os grupos (tabela 1), com exceção de maior hipoxémia (58,8 versus 63,3mmHg, p=0,023) e maior número de comorbilidades no GC. No GA o número médio de comorbilidades era de 1,9 e as mais frequentes foram as doenças cardiovasculares (41,7%), seguido da dislipidémia (20,8%) e diabetes (16,7%). Os doentes do GC tinham em média 3 comorbilidades, sendo as mais frequentes as doenças cardiovasculares (75%) e a síndrome da apneia obstrutiva do sono (62,5%) (tabela 1).
Características clínicas e demográficas dos 2 grupos
| GA | GC | Valor p | |
|---|---|---|---|
| Doentes | 24 | 8 | |
| Masculino / Feminino | 20 (83,3) / 4 (16,7) | 7 (87,5) / 1 (12,5) | ns |
| Idade (anos) | 65,7 ± 10,3 | 70,1 ± 5,2 | ns |
| Ex-fumadores / não fumadores | 21 (87,5) / 3 (12,5) | 8 (100) / 0 (0) | ns |
| Escala de ansiedade - depressão | ns | ||
| Ansiedade | 5,5 ± 3,4 | 5,1 ± 4,1 | |
| Depressão | 5,0 ± 4,4 | 4,1 ± 2,8 | |
| Dispneia – MRC | 2,4 ± 1,1 | 2,3 ± 0,8 | ns |
| Patologia pulmonar | |||
| DPOC | 13 (54,2) | 5 (62,5) | ns |
| DPOC + sequelas TB | 6 (25,0) | 2 (25,0) | |
| Bronquiectasias | 5 (20,8) | 1 (12,5) | |
| DPOC | ns | ||
| Estádio iii do GOLD | 5 (26,3) | 0 (0) | |
| Estádio iv do GOLD | 14 (73,7) | 7 (100) | |
| Provas de função respiratória | ns | ||
| Obstrução não reversível | 20 (83,3) | 7 (87,5) | |
| Alteração ventilatória mista | 4 (16,7) | 1 (12,5) | |
| VEMS previsto | 42 ± 18,6 | 43,1 ± 13,8 | |
| Insuficiência respiratória | 18 (75,0) | 8 (100) | ns |
| PaO2(mmHg) | 63,3 ± 4,6 | 58,8 ± 4,1 | 0,023 |
| Oxigenoterapia de longa duração | 12 (50,0) | 5 (62,5) | ns |
| Comorbilidades (número) | 1,9 ± 0,3 | 3,0 ± 1,5 | 0,016 |
| Doença cardiovascular | |||
| Hipertensão arterial | 6 (25) | 4 (50) | |
| Cardiopatia isquémica | 3 (12,5) | 3 (37,5) | |
| Insuficiência cardíaca direita | 3 (12,5) | 1 (12,5) | |
| Insuficiência cardíaca congestiva | 1 (4,2) | 1 (12,5) | |
| Fibrilhação auricular | - | 1 (12,5) | |
| Acidente vascular cerebral | 1 (4,2) | 1 (12,5) | |
| Aneurisma da aorta | 1 (4,2) | 1 (12,5) | |
| Hipertensão arterial pulmonar | 1 (4,2) | - | |
| SAOS | 2 (8,3) | 5 (62,5) | |
| Doenças neuroendócrinas | |||
| Diabetes mellitus | 4 (16,7) | 1 (12,5) | |
| Dislipidémia | 5 (20,8) | 1 (12,5) | |
| Outras | 4 (16,7) | 1 (12,5) | |
| Doença hepática | 3 (12,5) | - | |
| Hipertrofia benigna da próstata | 3 (12,5) | 2 (25) | |
| Osteoporose | - | 2 (25) | |
| Outras | 5 (20,8) | 2 (25) | |
| Índice de Charlson | 1,4 ± 0,6 | 1,6 ± 0,8 | ns |
| Modalidade de treino | ns (0,088) | ||
| Tapete rolante | 18 (75) | 3 (37,5) | |
| Bicicleta | 6 (25) | 5 (62,5) | |
| Duração PRR (semanas) | 26,7 ± 8,7 | 25,5 ± 4,6 | ns |
| Intensidade alvo atingida (%) | 81,7 ± 7,1 | 80,0 ± 0 | ns |
Dados apresentados em número (%) e média ± desvio padrão.
GA: grupo ativo; GC: grupo controlo; NS: estatisticamente não significativo; MRC: Medical Research Council; DPOC: Doença Pulmonar Obstrutiva Crónica; TB: tuberculose; GOLD: Global initiative for chronic Obstructive Lung Disease; VEMS: volume expiratório máximo no 1.° segundo; PRR: programa de reabilitação respiratória; SAOS: Síndrome de Apneia Obstrutiva do Sono.
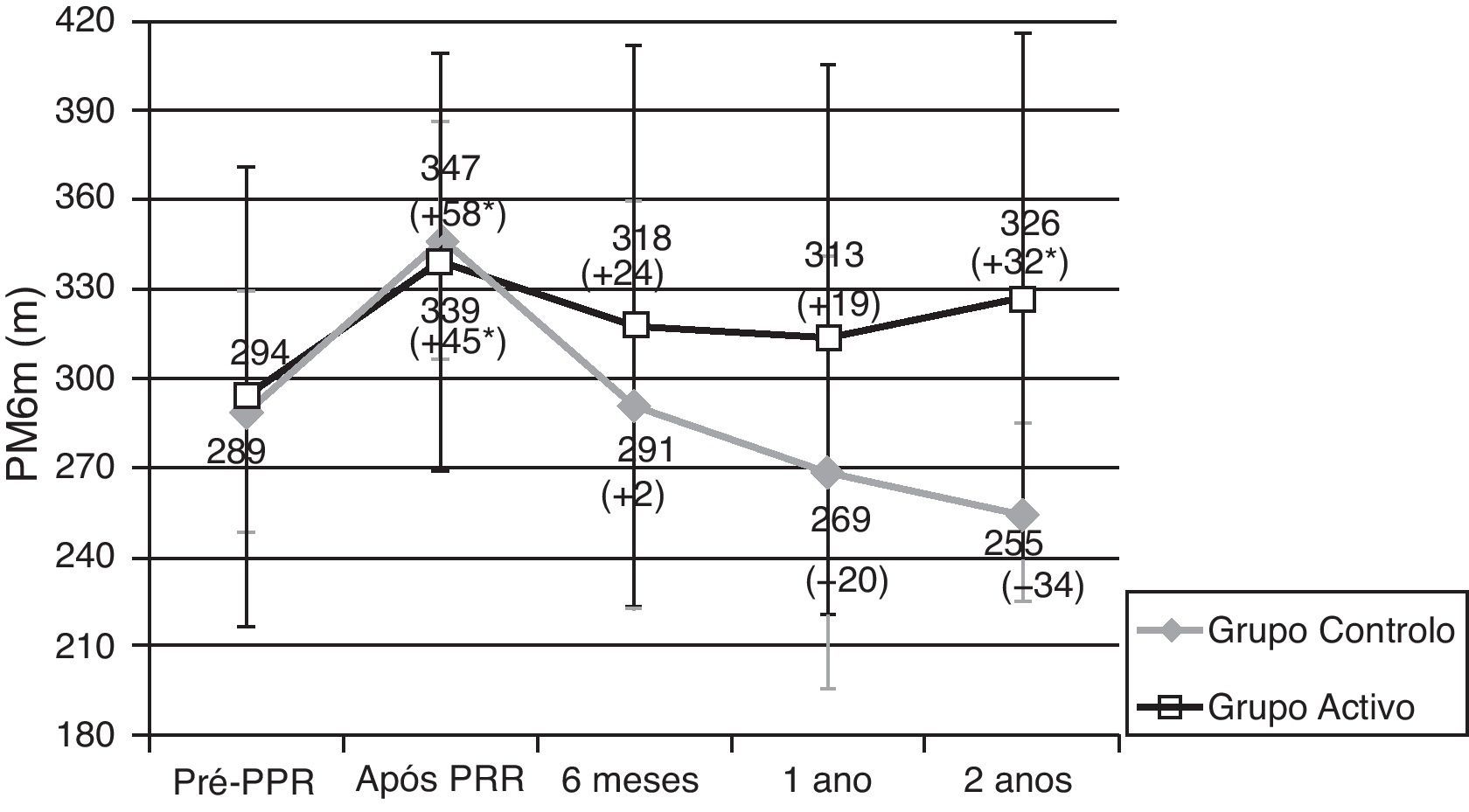
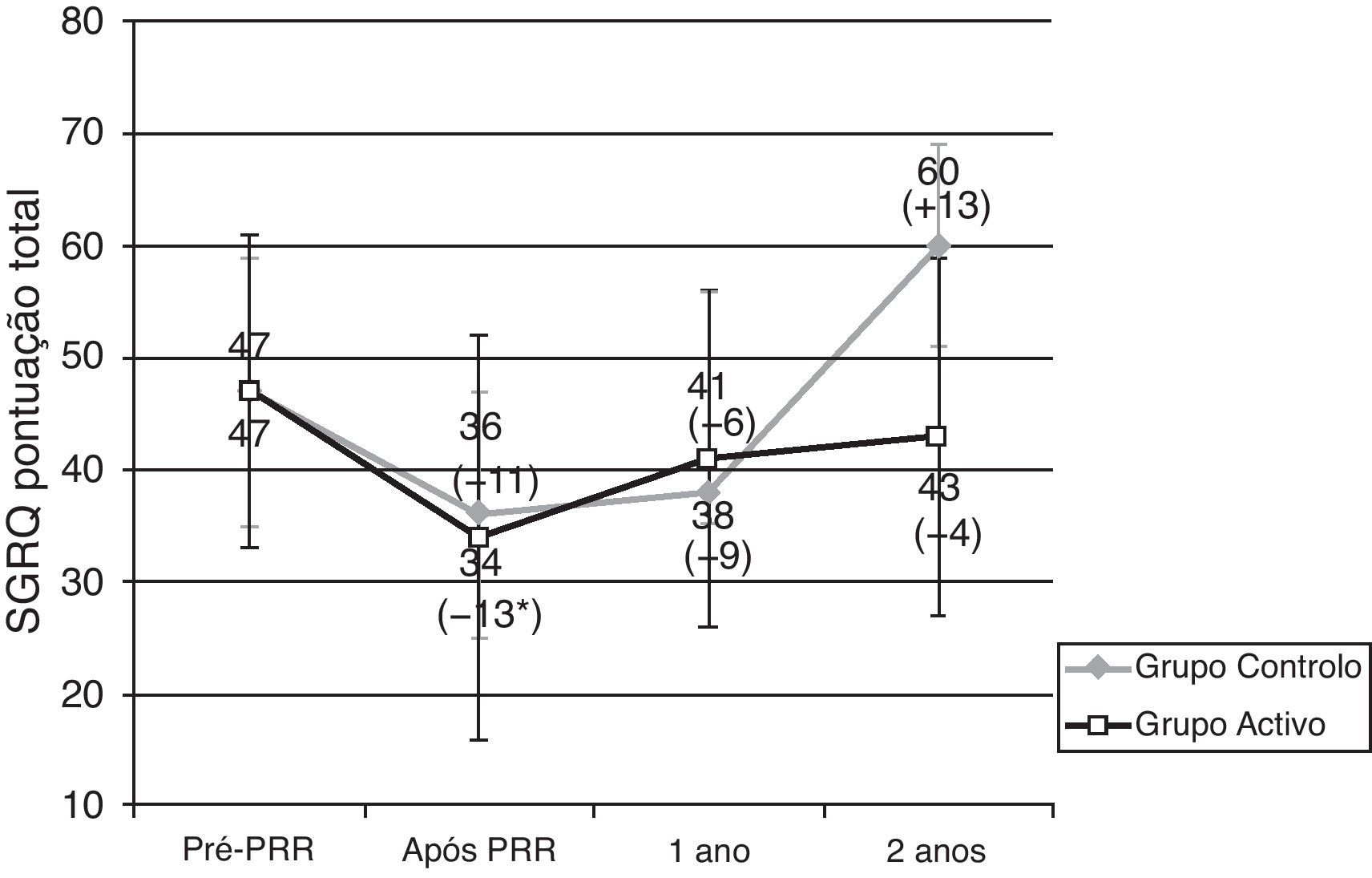
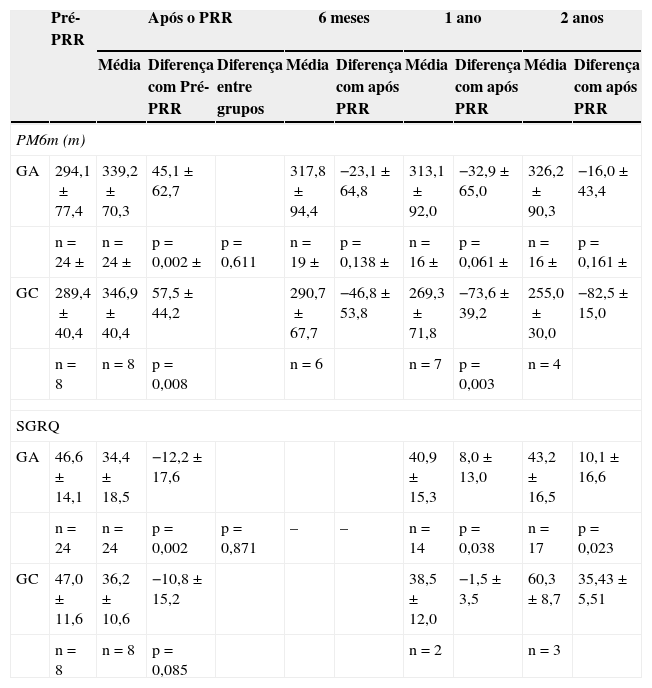
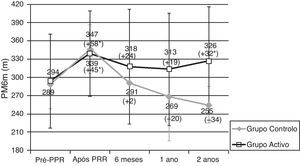
Os doentes do GA e GC tiveram resultados semelhantes na PM6m e no SGRQ, antes do PRR (tabela 2, figs. 1 e 2). Imediatamente após o PRR, todos os doentes obtiveram uma melhoria significativa na distância média da PM6m (fig. 1) e na pontuação total do SGRQ (fig. 2). No GA observou-se uma melhoria de 45,1m na PM6m (p=0,002) e 12,2 pontos na pontuação total do SGRQ (p=0,002) (tabela 2, figs. 1 e 2). Os doentes do GC tiveram uma melhoria de 57,5m na PM6m (p=0,008) e menos 10,8 pontos na pontuação total do SGRQ (p=0,085) (tabela 2, figs. 1 e 2). Não se verificaram diferenças estatisticamente significativas entre os grupos.
Capacidade de exercício e estado de saúde
| Pré-PRR | Após o PRR | 6 meses | 1 ano | 2 anos | ||||||
|---|---|---|---|---|---|---|---|---|---|---|
| Média | Diferença com Pré-PRR | Diferença entre grupos | Média | Diferença com após PRR | Média | Diferença com após PRR | Média | Diferença com após PRR | ||
| PM6m (m) | ||||||||||
| GA | 294,1±77,4 | 339,2±70,3 | 45,1±62,7 | 317,8±94,4 | −23,1±64,8 | 313,1±92,0 | −32,9±65,0 | 326,2±90,3 | −16,0±43,4 | |
| n=24± | n=24± | p=0,002± | p=0,611 | n=19± | p=0,138± | n=16± | p=0,061± | n=16± | p=0,161± | |
| GC | 289,4±40,4 | 346,9±40,4 | 57,5±44,2 | 290,7±67,7 | −46,8±53,8 | 269,3±71,8 | −73,6±39,2 | 255,0±30,0 | −82,5±15,0 | |
| n=8 | n=8 | p=0,008 | n=6 | n=7 | p=0,003 | n=4 | ||||
| SGRQ | ||||||||||
| GA | 46,6±14,1 | 34,4±18,5 | −12,2±17,6 | 40,9±15,3 | 8,0±13,0 | 43,2±16,5 | 10,1±16,6 | |||
| n=24 | n=24 | p=0,002 | p=0,871 | – | – | n=14 | p=0,038 | n=17 | p=0,023 | |
| GC | 47,0±11,6 | 36,2±10,6 | −10,8±15,2 | 38,5±12,0 | −1,5±3,5 | 60,3±8,7 | 35,43±5,51 | |||
| n=8 | n=8 | p=0,085 | n=2 | n=3 | ||||||
Dados apresentados em média ± desvio padrão.
GA: grupo activo; GC: grupo controlo; PRR: Programa de Reabilitação Pulmonar; PM6m: prova de marcha dos 6 minutos; SGRQ: Questionário de St George na doença respiratória.
Resultados da prova de marcha dos 6 minutos (PM6m). Dados apresentados em média ± desvio padrão.
PRR: programa de reabilitação respiratória. * Melhoria significativa após reabilitação (p < 0,05). Diferença (em metros) Após- Pré PRR aparece entre parêntesis.
Dimensão da amostra: 24, 24, 19, 16, 16 para pré-PRR, após PRR, 6 meses, 1 ano e 2 anos, respectivamente no grupo activo; 8, 8, 6, 7, 4 para pré-PRR, após PRR, 6 meses, 1 ano e 2 anos, respetivamente no grupo controlo.
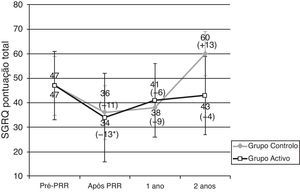
Resultados do questionário de St. George na doença respiratória (SGRQ). Dados apresentados em média ± desvio padrão.
PRR: programa de reabilitação respiratória. * Melhoria significativa após reabilitação (p < 0,05). Diferença (em metros) Após- Pré PRR aparece entre parêntesis.
Dimensão da amostra: 24, 24, 14, 17 para pré-PRR, após PRR, 1 ano e 2 anos, respetivamente no grupo activo; 8, 8, 2, 3 para pré-PRR, após PRR, 1 ano e 2 anos, respetivamente no grupo controlo.
Após o PRR, no GA houve uma diminuição da distância média percorrida na PM6m aos 6 meses (−23,1m), um ano (−32,9m) e 2 anos (−16,0m) (tabela 2). Contudo, estes doentes continuavam a apresentar uma distância média percorrida melhor do que antes do PRR (fig. 1) e 2 anos após o PRR, esta melhoria ainda era clínica (+32m) e estatisticamente significativa (p=0,034). Dois anos após o PRR, 69% dos doentes apresentavam uma distância percorrida na PM6m igual ou superior à percorrida antes do PRR.
Após completar o PRR, no GC observou-se uma tendência para um maior declínio na distância média percorrida na PM6m aos 6 meses (−46,8m), um ano (−73,6m) e 2 anos (−82,5m) (tabela 2). Após 2 anos, a distância percorrida na PM6m era, em média, menos 34 metros do que antes do PRR (fig. 1).
Quando terminaram o PRR em ambos os grupos verificou-se uma melhoria do estado de saúde. No GA, um ano e 2 anos após o PRR, o SGRQ médio era de 40,9 pontos e 43,2 pontos, respetivamente, valores mais elevados do que os obtidos imediatamente após o PRR. Contudo, o estado de saúde continuava a ser melhor do que os valores obtidos antes do PRR (tabela 2 e fig. 2). Dois anos após o PRR, 65% apresentavam um resultado melhor no SGRQ, do que antes do PRR.
Pelo contrário, no GC, verificou-se uma tendência para agravamento da pontuação total do SGRQ, especialmente 2 anos após o PRR, em que o valor médio do SGRQ foi de 60,3 pontos (13,3 pontos mais do que antes do PRR) (tabela 2 e fig. 2).
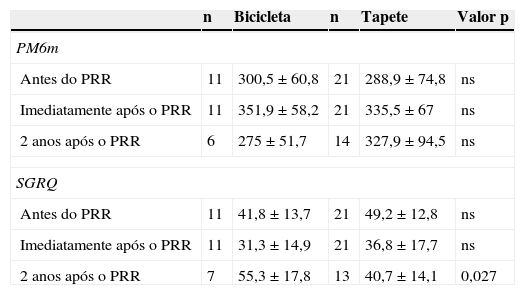
Considerando a modalidade de treino, os resultados na PM6m e SGRQ a curto prazo foram semelhantes nos doentes que treinaram em tapete e bicicleta. Contudo, 2 anos após o PRR, os doentes que treinaram em cicloergómetro apresentavam um resultado pior no SGRQ (55,3 pontos), do que os doentes que treinaram em tapete rolante (40,7 pontos) (p=0,027) (Anexo, tabela A1). Comparando com o GA (25%), no GC havia um maior número de doentes a treinar em cicloergómetro (62,5%), contudo esta diferença não era estatisticamente significativa.
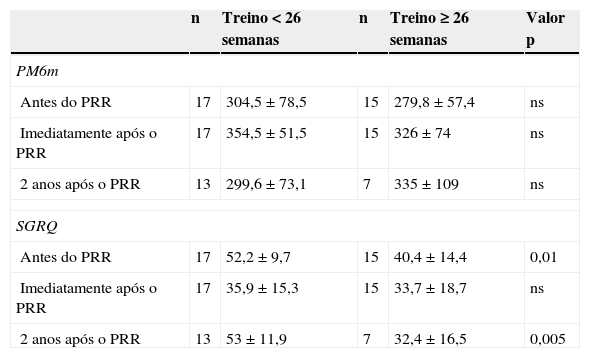
Considerando como ponto de corte na duração do PRR as 26 semanas, não se observaram diferenças na PM6m e no SGRQ a curto prazo. Contudo, 2 anos após o PRR, os doentes que tiveram um treino com duração inferior a 26 semanas apresentavam um resultado pior no SGRQ, do que os doentes que tiveram um treino mais prolongado (p=0,005) (Anexo, tabela A2).
Não se verificaram diferenças estatisticamente significativas na distância média percorrida na PM6m e na pontuação total do SGRQ relacionadas com o género e patologia pulmonar, nomeadamente no que diz respeito à presença de sequelas de tuberculose ou bronquiectasias. Também, não se observou qualquer correlação entre a idade ou o índice de Charlson e os resultados obtidos na PM6m e SGRQ (dados não apresentados).
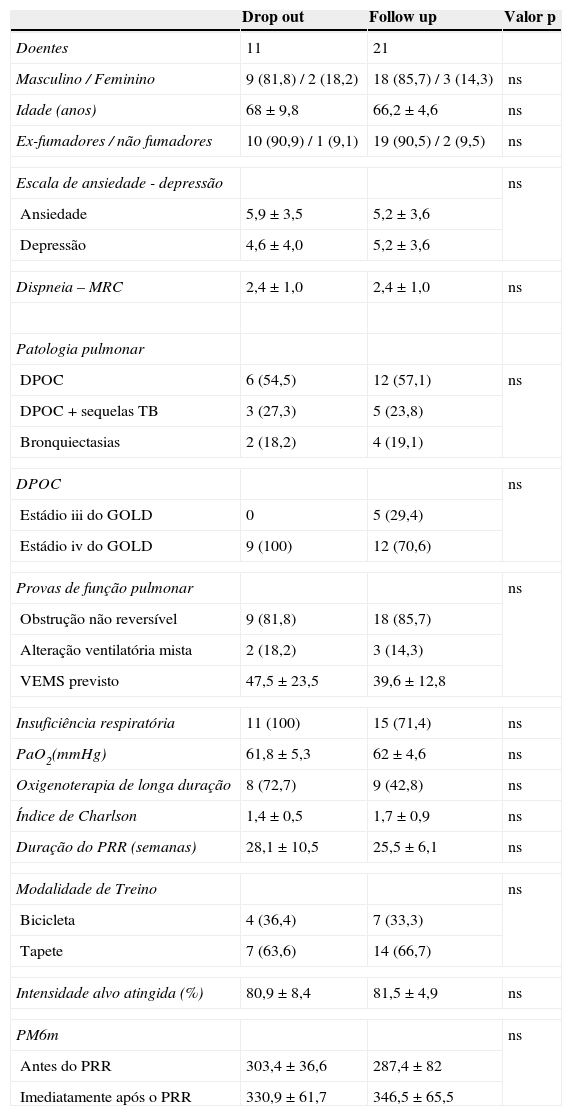
Ao longo do estudo, 7 doentes do GA (26%) e 4 do GC (50%) faltaram às consultas de follow up (figs. 1 e 2). As características clínicas e demográficas basais foram similares nos doentes que completaram o follow up e nos que saíram do estudo (drop out) (Anexo, tabela A3).
DiscussãoOs benefícios do PRR em doentes com patologia respiratória crónica são já conhecidos, estão bem documentados1–5, e foram igualmente observados neste estudo. Em ambos os grupos, após o PRR, os doentes apresentaram uma melhoria clínica e estatisticamente significativa no estado de saúde e na capacidade funcional.
No nosso estudo todos os doentes atingiram a intensidade alvo de 80% da potência de pico, situação distinta da reportada por Maltais et al.20, onde apenas 11,9% dos doentes com DPOC moderada e grave atingiram a intensidade alvo, após 12 semanas de treino. Todos os nossos doentes atingiram a intensidade alvo, porque a duração do treino foi ajustada de forma a alcançar este objetivo. Um treino de elevada intensidade permite atingir uma adaptação fisiológica mais pronunciada (menores necessidades ventilatórias, diminuição da acidose láctica e melhoria na tolerância ao exercício), tal como foi demonstrado por Casaburi et al.21.
Tanto quanto é do nosso conhecimento, este é o primeiro estudo onde a maioria dos doentes com DPOC grave e muito grave mantêm a melhoria na distância percorrida na PM6m e no estado de saúde, 2 anos após o PRR, quando comparado com os valores pré-PRR.
No nosso estudo a duração e localização do programa podem ter influenciado os bons resultados obtidos após o programa de reabilitação e a adesão do GA. A duração do nosso PRR é maior do que o habitual (cerca de 26 semanas), devido à gravidade e idade avançada dos doentes. Outros estudos constataram que programas mais longos parecem potenciar os efeitos a longo prazo2,22. Na nossa opinião, PRR mais longos, com um contacto próximo dos doentes e seus cuidadores com a equipa multidisciplinar, em contexto de hospital de dia, favorecem os bons resultados da reabilitação.
Heppner et al.23 também constataram que a prática de exercício regular após conclusão da reabilitação pulmonar está associada a um declínio mais lento no estado de saúde global e na capacidade de realizar caminhadas, bem como menor progressão da dispneia durante as atividades diárias. Contudo, neste estudo os doentes DPOC eram menos graves (moderados a graves).
Num estudo prévio, Spencer et al. demonstraram que a realização de treino de exercício supervisionado semanalmente em ambulatório era capaz de manter a capacidade funcional e o estado de saúde dos doentes durante 12 meses7. Nesse estudo, o grupo controlo, que realizava exercício não supervisionado em casa também manteve esses benefícios. O grupo controlo deste estudo era semelhante ao nosso GA e os resultados a longo prazo foram similares, contudo os doentes do nosso estudo eram mais graves (Spencer et al. estudaram doentes com DPOC moderada)7 e mantiveram estes benefícios durante 2 anos.
Noutro estudo, Brooks et al.9 compararam os efeitos de 2 programas pós-reabilitação ao nível da capacidade funcional e do estado de saúde em doentes com DPOC grave. Num grupo, os doentes eram observados em sessões mensais de grupo e recebiam um telefonema quinzenal da fisioterapeuta; no outro grupo, os doentes visitavam a fisioterapeuta a cada 3 meses. Tal como no nosso estudo observou-se, após o programa de reabilitação, uma melhoria significativa na PM6m e no SGRQ. Contudo, neste estudo houve uma deterioração franca na capacidade funcional e no estado de saúde, 12 meses após o término da reabilitação respiratória, em ambos os grupos.
A baixa adesão à prática de exercício regular tem um efeito prejudicial na morbilidade, mortalidade e recurso a cuidados de saúde9. Não temos uma explicação para a fraca adesão do GC a um estilo de vida ativo, uma vez que ambos os grupos apresentavam características clínicas e demográficas semelhantes e benefícios de magnitude similar com o PRR (tabela 1). A transferência das competências adquiridas pelo doente para o seu estilo de vida habitual pode ser dificultada por diversos obstáculos: falta de autoconfiança, alterações cognitivas, problemas comportamentais, baixa motivação e presença de barreiras físicas no domicílio ou na comunidade24,25. No nosso estudo, o Grupo Controlo, sendo menos aderente ao exercício, apresentou igualmente uma menor adesão às consultas de follow-up.
Os doentes que treinaram em bicicleta obtiveram, a longo prazo, piores resultados na capacidade funcional e no estado de saúde. Uma possível explicação poderá ter sido a dificuldade em manter esta modalidade de forma regular no domicílio e consequentemente, os doentes tornaram-se mais inativos.
Apesar da PaO2 média ser inferior no GC (p=0,023), o que poderia representar uma condição limitante, não havia diferença estatisticamente significativa no número de doentes em oxigenoterapia de longa duração (tabela 1). O GC apresentava um maior número de comorbilidades (3 versus 1,9, p=0,016), contudo o índice de Charlson era similar em ambos os grupos.
A idade, o género e a presença de sequelas de tuberculose ou as bronquiectasias também não tiveram aparente influência nos resultados.
Na nossa opinião a fraca adesão ao exercício pode ter causado deterioração da condição de saúde dos doentes do GC, com consequente redução da capacidade funcional e estado de saúde.
As limitações deste estudo incluem a pequena dimensão da amostra, com maior redução devido aos doentes que abandonaram o follow-up e o facto de se tratar de um estudo retrospetivo.
Apesar do auto-relato da atividade física ser um possível viés (uma vez que não conseguíamos confirmar os níveis de atividade física dos doentes), os resultados mostraram concordância, com maiores benefícios no grupo que afirmava manter exercício regular.
Os resultados deste estudo apontam para a necessidade de maior investigação nesta área, de forma a identificar características prognósticas relacionadas com sucesso / insucesso a longo prazo da reabilitação respiratória e o desenvolvimento de estratégias para manter os benefícios da reabilitação.
ConclusãoUm programa de reabilitação respiratória com cerca de 26 semanas de duração, num hospital de dia de insuficientes respiratórios, em doentes com doença pulmonar crónica grave e muito grave conduz a benefícios significativos na capacidade funcional e no estado de saúde. Esses benefícios diminuem após término do programa, mas mantêm-se significativamente positivos 2 anos após sua conclusão, em doentes motivados e aderentes à prática de exercício.
A prática de exercício regular após um programa de reabilitação parece ser um fator protetor contra a perda de capacidade funcional e do estado de saúde em doentes com doença pulmonar crónica grave e muito grave.
Apesar de a amostra ser pequena, este estudo comprova a necessidade de implementar estratégias que assegurem a manutenção dos benefícios da Reabilitação Respiratória.
Conflito de interessesOs autores declaram não haver conflito de interesses.
À Dra. Manuela Zamith e ao Dr. Paulo Nicola pelos comentários após revisão deste trabalho.
Modalidade de treino e resultados na PM6m e SGRQ
| n | Bicicleta | n | Tapete | Valor p | |
|---|---|---|---|---|---|
| PM6m | |||||
| Antes do PRR | 11 | 300,5 ± 60,8 | 21 | 288,9 ± 74,8 | ns |
| Imediatamente após o PRR | 11 | 351,9 ± 58,2 | 21 | 335,5 ± 67 | ns |
| 2 anos após o PRR | 6 | 275 ± 51,7 | 14 | 327,9 ± 94,5 | ns |
| SGRQ | |||||
| Antes do PRR | 11 | 41,8 ± 13,7 | 21 | 49,2 ± 12,8 | ns |
| Imediatamente após o PRR | 11 | 31,3 ± 14,9 | 21 | 36,8 ± 17,7 | ns |
| 2 anos após o PRR | 7 | 55,3 ± 17,8 | 13 | 40,7 ± 14,1 | 0,027 |
SGRQ: questionário de St. George na doença respiratória; PM6m: prova de marcha dos 6 minutos; PRR: programa de reabilitação respiratória; NS: estatisticamente não significativo.
Duração do treino e resultados na PM6m e SGRQ
| n | Treino < 26 semanas | n | Treino ≥ 26 semanas | Valor p | |
|---|---|---|---|---|---|
| PM6m | |||||
| Antes do PRR | 17 | 304,5 ± 78,5 | 15 | 279,8 ± 57,4 | ns |
| Imediatamente após o PRR | 17 | 354,5 ± 51,5 | 15 | 326 ± 74 | ns |
| 2 anos após o PRR | 13 | 299,6 ± 73,1 | 7 | 335 ± 109 | ns |
| SGRQ | |||||
| Antes do PRR | 17 | 52,2 ± 9,7 | 15 | 40,4 ± 14,4 | 0,01 |
| Imediatamente após o PRR | 17 | 35,9 ± 15,3 | 15 | 33,7 ± 18,7 | ns |
| 2 anos após o PRR | 13 | 53 ± 11,9 | 7 | 32,4 ± 16,5 | 0,005 |
SGRQ: questionário de St. George na doença respiratória; PM6m: prova de marcha dos 6 minutos; PRR: programa de reabilitação respiratória; NS: estatisticamente não significativo.
Características basais dos doentes que completaram o follow-up e dos doentes que abandonaram (drop out)
| Drop out | Follow up | Valor p | |
|---|---|---|---|
| Doentes | 11 | 21 | |
| Masculino / Feminino | 9 (81,8) / 2 (18,2) | 18 (85,7) / 3 (14,3) | ns |
| Idade (anos) | 68 ± 9,8 | 66,2 ± 4,6 | ns |
| Ex-fumadores / não fumadores | 10 (90,9) / 1 (9,1) | 19 (90,5) / 2 (9,5) | ns |
| Escala de ansiedade - depressão | ns | ||
| Ansiedade | 5,9 ± 3,5 | 5,2 ± 3,6 | |
| Depressão | 4,6 ± 4,0 | 5,2 ± 3,6 | |
| Dispneia – MRC | 2,4 ± 1,0 | 2,4 ± 1,0 | ns |
| Patologia pulmonar | |||
| DPOC | 6 (54,5) | 12 (57,1) | ns |
| DPOC + sequelas TB | 3 (27,3) | 5 (23,8) | |
| Bronquiectasias | 2 (18,2) | 4 (19,1) | |
| DPOC | ns | ||
| Estádio iii do GOLD | 0 | 5 (29,4) | |
| Estádio iv do GOLD | 9 (100) | 12 (70,6) | |
| Provas de função pulmonar | ns | ||
| Obstrução não reversível | 9 (81,8) | 18 (85,7) | |
| Alteração ventilatória mista | 2 (18,2) | 3 (14,3) | |
| VEMS previsto | 47,5 ± 23,5 | 39,6 ± 12,8 | |
| Insuficiência respiratória | 11 (100) | 15 (71,4) | ns |
| PaO2(mmHg) | 61,8 ± 5,3 | 62 ± 4,6 | ns |
| Oxigenoterapia de longa duração | 8 (72,7) | 9 (42,8) | ns |
| Índice de Charlson | 1,4 ± 0,5 | 1,7 ± 0,9 | ns |
| Duração do PRR (semanas) | 28,1 ± 10,5 | 25,5 ± 6,1 | ns |
| Modalidade de Treino | ns | ||
| Bicicleta | 4 (36,4) | 7 (33,3) | |
| Tapete | 7 (63,6) | 14 (66,7) | |
| Intensidade alvo atingida (%) | 80,9 ± 8,4 | 81,5 ± 4,9 | ns |
| PM6m | ns | ||
| Antes do PRR | 303,4 ± 36,6 | 287,4 ± 82 | |
| Imediatamente após o PRR | 330,9 ± 61,7 | 346,5 ± 65,5 | |
Dados apresentados em número (%) e média ± desvio padrão.
NS: estatisticamente não significativo; MRC: Medical Research Council; DPOC: Doença Pulmonar Obstrutiva Crónica; TB: tuberculose; GOLD: Global initiative for chronic Obstructive Lung Disease; FEV1: volume expiratório máximo no 1.° segundo; PRR: programa de reabilitação respiratória; PM6m: prova de marcha dos 6 minutos.