A síndrome de Churg-Strauss (SCS) é uma vasculite sistémica necrotizante, que afeta os vasos de pequeno e médio calibre e se associa a granulomas eosinofílicos extravasculares, eosinofilia periférica e asma.
É uma síndrome rara, de etiologia desconhecida e que afeta ambos os géneros e todos os grupos etários.
Os doentes com SCS geralmente apresentam boa resposta à terapêutica com glucocorticoides, embora as recidivas sejam frequentes após a sua suspensão. O diagnóstico e terapêutica atempada levam geralmente a um bom prognóstico, com uma sobrevivência de 90% um ano após o diagnóstico.
Neste artigo é apresentada uma breve revisão da SCS, com particular atenção ao diagnóstico, terapêutica e progressos recentes nesta área.
De seguida, os autores apresentam e discutem as características clínicas, laboratoriais e imagiológicas de quatro doentes internados num Serviço de Medicina Interna com este diagnóstico. O tratamento instituído, as respostas observadas e o seguimento dos casos são também descritos.
Churg-Strauss syndrome (CSS) is a systemic necrotizing vasculitis of the small and medium vessels, associated with extravascular eosinophilic granulomas, peripheral eosinophilia and asthma.
This is a rare syndrome of unknown etiology, affecting both genders and all age groups.
CSS patients usually respond well to steroid treatment, although relapses are common after it ends. Timely diagnosis and treatment generally lead to a good prognosis with a 90% survival rate at one year.
A brief review of CSS is presented, with particular attention to diagnosis, therapy and recent developments in this area.
The authors then report and discuss the clinical, laboratory and imaging characteristics of four patients admitted to an Internal Medicine Department with this diagnosis. The treatment, response and follow-up of the cases are also described.
A síndrome de Churg-Strauss (SCS), também denominada angeíte granulomatosa alérgica é uma vasculite sistémica necrotizante, inicialmente descrita pelos patologistas J. Churg e L. Strauss, numa série de autópsias de doentes com asma grave1. Estes doentes apresentavam hipereosinofilia e vasculite sistémica, enquanto o exame histológico demonstrava granulomas extravasculares, eosinofilia tecidular e vasculite necrotizante.
A descrição de mais casos levou a uma melhoria da definição, sendo que hoje em dia os critérios de classificação do American College of Rheumatology (ACR) em doentes com vasculite em biopsia são os mais aceites2. Estes critérios incluem asma, eosinofilia periférica superior a 10%, mono ou polineuropatia, infiltrados pulmonares migratórios, patologia dos seios paranasais e eosinófilos extravasculares na biopsia. A presença de quatro destes critérios num doente com vasculite demonstrada por biopsia tem uma sensibilidade de 85% e uma especificidade de 99,7% para SCS2.
A SCS é uma doença muito rara, com uma incidência de 1 a 7 casos por milhão de indivíduos por ano3,4. A doença afeta igualmente ambos os sexos e pode surgir em qualquer idade, com uma idade média à data da apresentação de 50 anos5,6.
EtiologiaA etiologia da SCS é desconhecida. As hipóteses propostas incluem um processo autoimune, possivelmente associado a fatores genéticos e ambientais7.
Os antagonistas dos recetores dos leucotrienos (ARL), incluindo o zafirlucaste e o montelucaste foram associados ao desenvolvimento de SCS, na última década. Este efeito relaciona-se provavelmente com a suspensão dos corticoides após o início da toma de ARLs em doentes com SCS até então atenuado, ou a prescrição de ARLs a doentes com asma progressiva que era na realidade SCS progressiva não identificada8,9. De facto, existem relatos de casos de SCS após o início de corticoides inalados10 e omalizumab11 e um estudo cruzado recente mostrou que várias das medicações de controlo da asma estão associadas com o início de SCS, suportando a hipótese que o que se associa ao início da SCS é um agravamento da asma e não um fármaco específico12.
FisiopatologiaA fisiopatologia da SCS é insuficientemente conhecida. Uma característica particular da doença é a proeminente eosinofilia sanguínea e tecidular, que se relaciona com a atividade da doença13. Em doentes com a patologia ativa, os eosinófilos expressam marcadores de superfície de ativação14 e segregam proteínas que levam a dano tecidular15. A eosinofilia parece ser mantida pelo aumento da libertação da IL-5, produzida principalmente por linfócitos Th2 ativados16. Com efeito, o anticorpo anti-IL5 mepolizumab mostrou-se eficaz na SCS refratária, num estudo recente17. Embora a SCS seja principalmente associada a um perfil Th2, estudos recentes também demonstraram possíveis desequilíbrios na atividade dos linfócitos Th118, T reguladores19 e Th1720. Os anticorpos anticitoplasma do neutrófilo (ANCA), especificamente antimieloperoxidase parecem ter um papel patogénico nas lesões de vasculite, possivelmente através da ativação de neutrófilos, levando à libertação de espécies reativas de oxigénio e enzimas proteolíticas21. Os papéis propostos para os eosinófilos e ANCA na patogénese da doença estão de acordo com as recentes descrições de diferentes manifestações da doença em doentes com e sem ANCA.
Manifestações clínicasAs manifestações clínicas da SCS são geralmente descritas em três fases:
A primeira fase (prodrómica) pode durar vários anos. As características predominantes são a asma atópica e a rinite, geralmente de difícil controlo.
Na segunda fase (eosinofílica) observa-se uma infiltração tecidular intensa por eosinófilos em vários órgãos, incluindo os pulmões e o trato gastro-intestinal (GI), eventualmente evoluindo para síndrome de Loeffler ou gastroenterite eosinofílica.
A terceira fase (vasculítica) é caracterizada por uma vasculite sistémica acentuada, em que os sintomas gerais geralmente precedem o envolvimento dos vários órgãos por este processo22.
Um dos sistemas que é frequentemente afetado pela vasculite é o sistema nervoso periférico, com envolvimento dos vasa vasorum e desenvolvimento de mononeurite multiplex23. O trato GI é também afetado, tendo como manifestações a dor abdominal, gastroenterite ou mesmo um quadro de abdómen agudo24. O envolvimento cardíaco pode apresentar-se como miocardite, insuficiência cardíaca, pericardite ou mesmo vasculite coronária e consequente isquémia miocárdica. Cerca de metade das mortes relacionadas com a SCS são causadas por lesões cardíacas25.
O sistema respiratório é envolvido em virtualmente todos os doentes, não só com asma na primeira fase clínica, mas também com infiltrados na radiografia de tórax, que estão presentes em 37 a 77% de todos os doentes. O derrame pleural também pode ser observado em até um terço dos doentes26–28.
A doença renal clinicamente significativa é menos frequente e menos grave que em outras formas de vasculite24.
Subtipos de doençaEstudos recentes demonstraram a existência de duas populações diferentes de doentes com SCS. Os doentes ANCA positivos (40% nestes estudos) apresentam mais frequentemente manifestações relacionadas com a vasculite incluindo envolvimento renal e do sistema nervoso periférico, assim como hemorragia alveolar, púrpura e vasculite na biopsia. Os doentes ANCA negativos têm mais frequentemente manifestações relacionadas com a infiltração por eosinófilos, incluindo sintomas cardíacos, pulmonares e sistémicos. A relevância destes achados na terapêutica e prognóstico da SCS não é ainda clara29.
Achados laboratoriais e diagnósticoO diagnóstico de SCS está geralmente dependente da análise histológica, embora esta possa ser desnecessária, se o doente apresentar eosinofilia e as manifestações clínicas típicas. As amostras de tecido mais frequentemente obtidas provêm do trato gastro-intestinal (enterocolite eosinofílica com vasculite granulomatosa ou necrotizante) e da pele, onde podem ser encontrados vários padrões de lesão (até no mesmo doente), incluindo granulomas extravasculares, vasculite leucocitoclástica e poliarterite nodosa cutânea.
As biopsias do nervo mostram frequentemente vasculite necrotizante epineural. O pulmão é também frequentemente biopsado, revelando padrões de asma brônquica, pneumonia eosinofílica e granulomatose extravascular30–32.
Os dois achados mais sugestivos e frequentes de SCS são vasculite necrotizante e granulomas extravasculares necrotizantes, com infiltrados eosinofílicos. Estes achados não são, no entanto, patognomónicos33.
Nas análises sanguíneas destaca-se um aumento dos marcadores de inflamação e uma eosinofilia periférica intensa. Os títulos de IgE e de fator reumatoide também estão frequentemente elevados. Os ANCA estão tipicamente presentes (40 a 70% dos doentes), mostrando um padrão peri-nuclear em quase todos os casos (p-ANCA)5.
O diagnóstico diferencial inclui a síndrome hipereosinofílica idiopática, a pneumonia eosinofílica crónica e várias outras formas de vasculite sistémica5,34,35.
TratamentoO tratamento da SCS é similar ao de várias outras vasculites de pequenos vasos. A base do tratamento são os corticosteroides em doses elevadas que são geralmente iniciados numa dose de 1mg/kg/dia (máx. 60mg/dia) de prednisolona, mantida até ao controlo dos sintomas, com regressão lenta (durante um ano). Em doentes que apresentam fatores que predizem um mau prognóstico (envolvimento do sistema nervoso central, renal, cardíaco ou gastro-intestinal), a combinação de corticosteroides com ciclofosfamida produziu melhores resultados no controlo e manutenção da remissão6, comparativamente aos corticoides isolados e é assim recomendada para a indução de remissão pelas recomendações da European League Against Rheumatism (EULAR) para a abordagem das vasculites de pequenos e médios vasos. No caso de doença que não põe em risco a vida ou órgãos, o mesmo documento recomenda o uso de metotrexato como uma alternativa menos tóxica à ciclofosfamida. Para a manutenção de remissão é usada a combinação de corticoides em doses baixas com azatiopirina, leflunomida ou metotrexato36.
Os doentes que não respondem ou recidivam apesar da terapêutica adequada são sujeitos a outras terapêuticas, incluindo o micofenolato mofetil37, imunoglobulina humana intravenosa38 e agentes biológicos incluindo o rituximab39, o interferão-alfa40,41, e o mepolizumab17,42.
PrognósticoNa ausência de tratamento, a SCS pode ser rapidamente fatal após o estabelecimento da vasculite. O tratamento com corticoides leva a uma resposta significativa em 90% dos doentes, embora cerca de 20% venham a necessitar de terapêutica citotóxica adicional.
O tratamento altera drasticamente o prognóstico dos doentes com SCS (até 90% de sobrevivência a um ano). No entanto, após a suspensão dos corticoides, observa-se recidiva em até 25% dos doentes nos primeiros cinco anos, sendo a asma e a sinusite as manifestações mais frequentes43. A maioria das recidivas apresenta uma boa resposta aos corticoides. A principal causa de morbilidade crónica em doentes com SCS é a doença neurológica37,43.
A mortalidade nos doentes com SCS é geralmente o resultado de envolvimento cardíaco ou GI, com miocardite, insuficiência cardíaca, pericardite, ou mesmo vasculite coronária no primeiro e hemorragia, perfuração ou necrose entero-cólica no segundo. O acidente vascular cerebral hemorrágico pode ser também uma causa de morte.
Através da análise de um elevado número de casos, Guillevin e colaboradores reconheceram cinco fatores associados a um pior prognóstico, quando presentes à altura do diagnóstico (cardiomiopatia, envolvimento do SNC, doença GI grave, insuficiência renal com creatinina superior a 1,58mg/dl e proteinúria superior a 1g/dia)44.
MétodosForam incluídos todos os doentes internados num Serviço de Medicina Interna que cumpriam os critérios de diagnóstico da ACR para SCS, durante um período de 24 anos. As características clínicas, laboratoriais, imagiológicas e os dados do seguimento foram obtidos através da consulta dos processos clínicos.
ResultadosDoentesForam incluídos quatro doentes (2H/2M), com uma idade média de 48 anos (34-60).
Resumos dos casosDoente 1Uma doente do sexo feminino, de 46 anos apresentou-se com perda de peso, parestesias, mialgias, artralgias e perda de força muscular nos membros inferiores no último mês e dor abdominal, diarreia, febre e sudorese noturna nos últimos quatro dias. Também se queixava de tosse produtiva e agravamento da dispneia nos últimos dias. Os antecedentes patológicos incluíam asma e sinusite nos últimos dois anos. O exame físico revelou lesões maculo-papulares no pé esquerdo, hiporreflexia generalizada e perda da força muscular nos membros inferiores. As análises sanguíneas mostraram eosinofilia marcada e a biopsia cutânea mostrou sinais de vasculite com eosinófilos nas paredes dos vasos. O tratamento com prednisolona oral em dose elevada e ciclofosfamida levou a uma rápida resposta e a doente manteve-se assintomática. Três anos mais tarde foi diagnosticada uma recidiva que foi tratada com o mesmo regime, com bons resultados.
Doente 2Um doente do sexo masculino, de 34 anos foi internado devido a queixas de astenia, anorexia, mialgias difusas e perda de peso nas últimas três semanas. Também se queixava de dispneia, tosse produtiva e lesões cutâneas nos membros inferiores. Dos antecedentes destacava-se asma e doença dos seios paranasais com polipose há quatro anos. O exame físico foi compatível com polineuropatia. Os testes sanguíneos revelaram uma eosinofilia significativa e a TC torácica revelou um infiltrado pulmonar. A biopsia da pele mostrou aspetos de granuloma de Churg-Strauss e eosinófilos extravasculares. O tratamento com prednisolona em dose elevada causou uma melhoria rápida e significativa e o doente mantém-se em seguimento por asma controlada.
Doente 3Uma doente do sexo feminino de 60 anos apresentou-se com dor e parestesia na mão esquerda e perna direita há uma semana e dor abdominal e diarreia há dois meses. Tinha-lhe sido diagnosticada asma e rinite há 9 anos. No exame neurológico apresentava ataxia e perda de força muscular nos membros inferiores. Os testes sanguíneos mostraram eosinofilia marcada e a imagiologia torácica revelou infiltrados pulmonares migratórios. A biopsia da mucosa cólica foi compatível com colite eosinofílica. Foi tratada com prednisolona e gabapentina e posteriormente ciclofosfamida ev, mas manteve queixas neurológicas significativas. Isto levou ao uso de imunoglobulina humana EV com melhoria após 6 ciclos.
Doente 4Doente do sexo masculino, de 53 anos com uma história de 4 meses de vasculite cutânea nos membros inferiores e dor abdominal e diarreia no último mês. Os antecedentes incluíam asma desde há 3 anos, alcoolismo até 18 meses antes e miocardiopatia dilatada com insuficiência cardíaca grave há dois anos. O exame físico mostrou hiporreflexia, hipostesia e petéquias nos membros inferiores. As análises ao sangue revelaram eosinofilia e uma TC dos seios paranasais mostrou sinais de sinusite. A biopsia da mucosa cólica foi compatível com colite eosinofílica e a biopsia cutânea revelou vasculite eosinofílica. O tratamento com prednisolona causou uma rápida melhoria de todas as queixas, mas o doente faleceu duas semanas após a alta, de causa indeterminada.
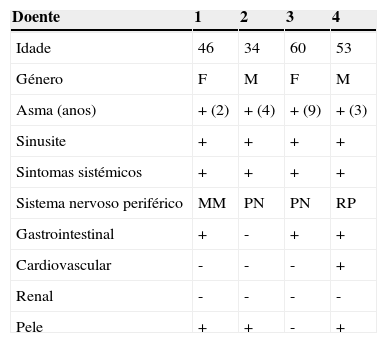
Descrição da casuísticaCaracterísticas clínicasAs características clínicas dos doentes estão resumidas na tabela 1.
Características clínicas dos doentes à altura do diagnóstico: (MM: mononeurite multiplex; PN: polineuropatia; RP: radiculopatia).
| Doente | 1 | 2 | 3 | 4 |
|---|---|---|---|---|
| Idade | 46 | 34 | 60 | 53 |
| Género | F | M | F | M |
| Asma (anos) | + (2) | + (4) | + (9) | + (3) |
| Sinusite | + | + | + | + |
| Sintomas sistémicos | + | + | + | + |
| Sistema nervoso periférico | MM | PN | PN | RP |
| Gastrointestinal | + | - | + | + |
| Cardiovascular | - | - | - | + |
| Renal | - | - | - | - |
| Pele | + | + | - | + |
Todos os doentes apresentavam envolvimento sistémico, pulmonar e do sistema nervoso. Os sintomas sistémicos incluíram febre, perda de peso e mialgias difusas. Todos os doentes tinham asma, e dois apresentavam também queixas de agravamento da dispneia e tosse produtiva. Embora apenas dois doentes se queixassem de parestesias, todos apresentavam alterações no exame neurológico, incluindo fraqueza muscular em dois doentes e hipoestesia nos quatro. O trato GI estava afetado em três doentes, com diarreia e dor abdominal.
Foram encontradas alterações cutâneas em três doentes (sinais de vasculite nos membros inferiores).
Apenas um doente tinha envolvimento cardíaco, que era provavelmente preexistente à SCS, uma vez que teve início antes de todos os sintomas, exceto a asma, e estava provavelmente associado ao abuso alcoólico. Não foram relatadas alterações renais, oftálmicas ou articulares em nenhum dos doentes. Não foram também descritas alterações do sistema nervoso central.
Antecedentes patológicosDos antecedentes patológicos dos doentes realça-se o diagnóstico prévio de asma em todos eles, dois dos quais medicados com ARLs. Um dos doentes apresentava miocardiopatia dilatada com insuficiência cardíaca grave, provavelmente devida a alcoolismo crónico.
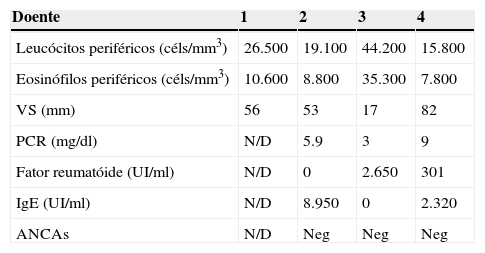
Alterações laboratoriaisO resumo das características laboratoriais de todos os doentes é apresentado na tabela 2.
Características laboratoriais dos doentes (VS: velocidade de sedimentação eritrocitária; PCR: proteína C reativa – normal < 0,5; IgE: imunoglobulina E total; N/D: não disponível).
| Doente | 1 | 2 | 3 | 4 |
|---|---|---|---|---|
| Leucócitos periféricos (céls/mm3) | 26.500 | 19.100 | 44.200 | 15.800 |
| Eosinófilos periféricos (céls/mm3) | 10.600 | 8.800 | 35.300 | 7.800 |
| VS (mm) | 56 | 53 | 17 | 82 |
| PCR (mg/dl) | N/D | 5.9 | 3 | 9 |
| Fator reumatóide (UI/ml) | N/D | 0 | 2.650 | 301 |
| IgE (UI/ml) | N/D | 8.950 | 0 | 2.320 |
| ANCAs | N/D | Neg | Neg | Neg |
Todos os doentes tinham leucocitose e eosinofilia à altura do diagnóstico, com os eosinófilos no sangue periférico a variar entre os 7800 e os 35.000 G/L. A velocidade de sedimentação eritrocitária estava elevada em três doentes. Os níveis de IgE foram quantificados em três doentes e estavam elevados em dois deles. Três doentes foram testados para ANCA, mas nenhum foi positivo.
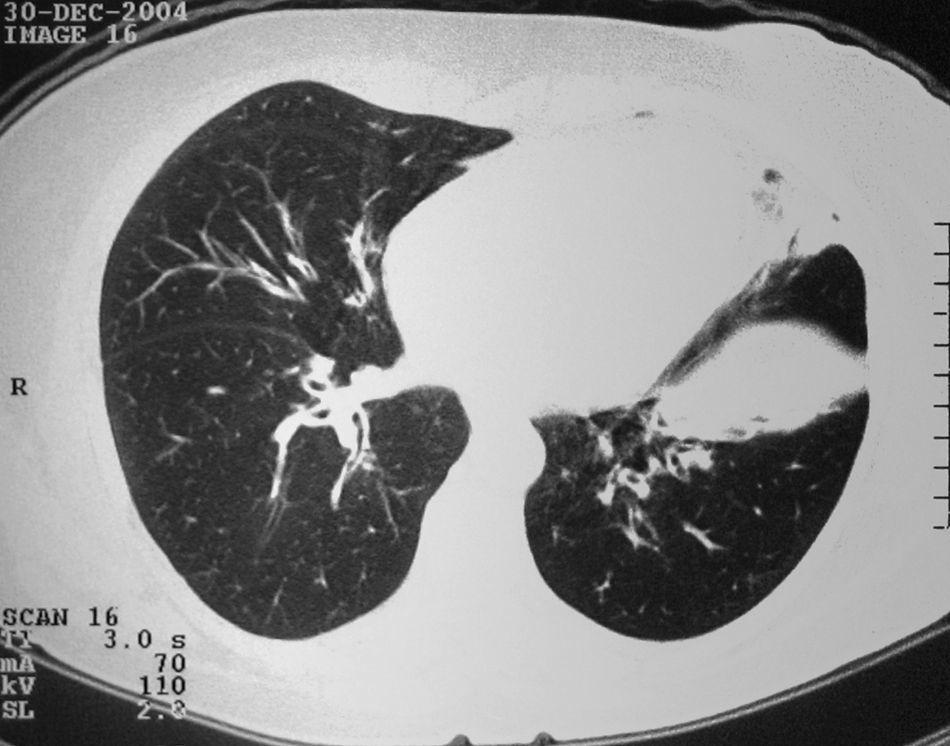
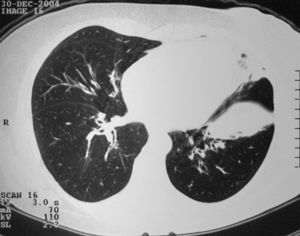
Três doentes apresentavam alterações relevantes na radiografia de tórax, com apenas um mostrando os infiltrados migratórios geralmente associados à SCS. A TC torácica foi realizada em três doentes, revelando alterações tanto no interstício como nos grandes brônquios (fig. 1).
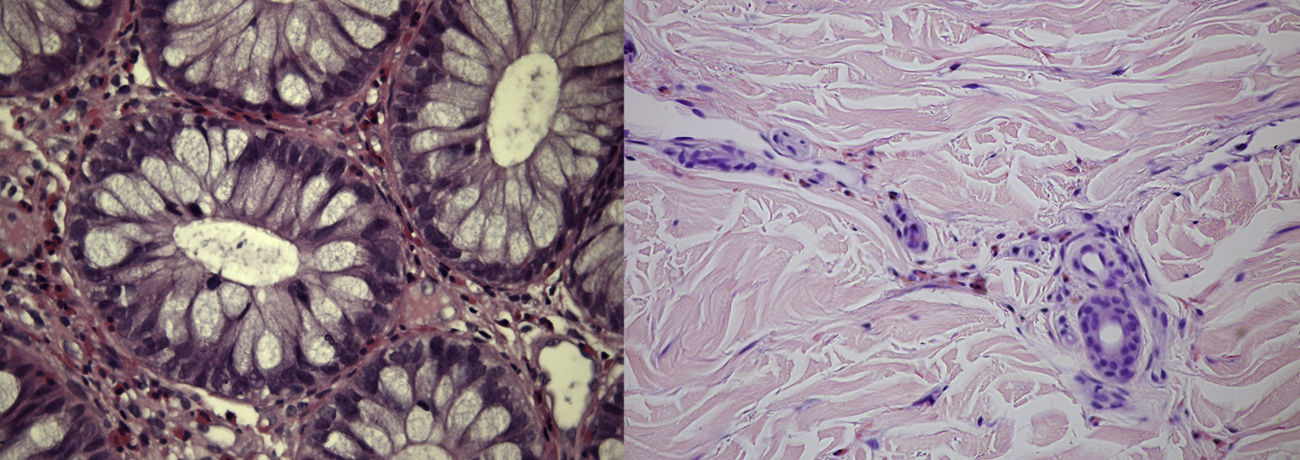
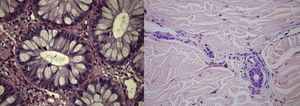
Análise histológicaTodos os doentes tiveram confirmação histológica do diagnóstico de vasculite. Dois foram sujeitos a biopsia cutânea, um a biopsia da mucosa cólica e o quarto foi sujeito a biopsia cutânea e da mucosa cólica. As biopsias da mucosa cólica mostraram aspetos de colite eosinofílica ativa (fig. 2) e as biopsias da pele revelaram aspetos de vasculite eosinofílica em dois doentes e o aspeto típico do granuloma de Churg-Strauss noutro.
TratamentoTodos os doentes receberam tratamento com altas doses de corticoides sistémicos (≥1mg/kg/dia de prednisolona ou equivalente).
Observou-se uma resposta imediata e relevante em todos os doentes, com melhoria de todas as queixas exceto as neurológicas em dois a quatro dias. As queixas neurológicas obrigaram à adição de outro fármaco em três doentes, nomeadamente ciclofosfamida num caso, gabapentina noutro e gabapentina e ciclofosfamida seguidos de gabapentina e imunoglobulina humana EV noutro.
SeguimentoNenhum dos doentes faleceu durante o internamento. Três estavam assintomáticos à altura da alta do hospital, 12 a 46 dias após a data de internamento. O outro doente manteve queixas neurológicas importantes (parestesias dos membros superiores com perda de função).
Um dos doentes foi perdido para o seguimento após 3 anos. Outro faleceu duas semanas após a alta, em casa, provavelmente devido a agravamento da sua insuficiência cardíaca secundária a miocardiopatia dilatada que estava presente antes do diagnóstico de SCS. Os outros dois doentes mantêm-se em seguimento, um deles (doente 3) mantendo queixas de asma e parestesia intensas dos membros superiores que apenas melhoraram após 6 ciclos de imunoglobulina humana endovenosa. O outro doente (doente 2) mantém apenas queixas de asma.
RecidivasFoi registada apenas uma recidiva, no doente 1, três anos após o diagnóstico, caracterizada por poliartralgias, lesões cutâneas e leucocitose com eosinofilia, todas com uma boa resposta à terapêutica com prednisolona e ciclofosfamida.
DiscussãoAs características clínicas e demográficas dos nossos doentes são similares às de casuísticas previamente publicadas45–47.
O facto de dois dos doentes estarem medicados com ARLs antes do diagnóstico não é particularmente relevante, uma vez que esses fármacos são frequentemente prescritos a doentes com asma atópica, tal como os doentes com SCS. Uma discussão detalhada da associação entre ARLs e SCS está para além deste artigo e pode ser encontrada noutro local9.
É importante, no entanto, sublinhar a alta taxa de envolvimento neurológico nos nossos doentes, embora apenas um demonstrasse o achado clássico de mononeurite multiplex. A radiculopatia já foi descrita previamente num doente com SCS, mas parece ser um achado raro48.
Considerando as análises sanguíneas, é de salientar que nenhum dos três doentes testados foi positivo para ANCA ao contrário da maioria das séries publicadas. Isto deve-se provavelmente ao pequeno número de doentes na nossa série.
As dificuldades no tratamento das complicações neurológicas são também relevantes, embora isto também já tenha sido referido noutras séries. Os bons resultados obtidos com o uso de imunoglobulina após a falha dos corticoides, gabapentina e ciclofosfamida já foram previamente descritos49.
Embora apenas estejam disponíveis dados de seguimento a longo prazo para dois doentes, a ausência de mortalidade durante o internamento está de acordo com o bom prognóstico reportado na literatura, após diagnóstico e terapêuticas atempados e corretos. Embora um dos doentes tenha falecido duas semanas após a alta, tal aconteceu, provavelmente, devido à sua patologia cardíaca prévia.
Em conclusão, a SCS é uma doença rara, mas de fácil diagnóstico, caso exista um alto grau de suspeição. É importante que todos os clínicos que lidam com doentes com asma ou vasculite tenham conhecimento das características clínicas, imagiológicas e laboratoriais desta doença, uma vez que a terapêutica atempada e correta tem consequências importantes quer na qualidade de vida quer na sobrevivência.
Conflito de interessesOs autores declaram não haver conflito de interesses.