A indução de esputo com soro hipertónico tem sido apontada como uma alternativa, mais económica e segura, ao lavado broncoalveolar na avaliação de doentes com doença pulmonar intersticial (DPI).
ObjetivoAvaliar a segurança e a exequibilidade do esputo induzido nas DPI e comparar os perfis celulares do estudo com os resultados obtidos por lavado broncoalveolar.
Material e métodosVinte doentes realizaram indução de esputo com soro hipertónico (4,5%) num intervalo de 2 semanas após a realização de lavado broncoalveolar. Foram analisadas as contagens diferenciais e a viabilidade celular. Para a análise foram utilizados os testes de Wilcoxon e a correlação de Spearman's e um valor de p<0,05 foi considerado estatisticamente significativo.
ResultadosDos 20 sujeitos estudados (média de idade 49,4±16,4 anos, 70% do sexo masculino), foi obtida uma amostra satisfatória de esputo em 15 (75%). A indução foi interrompida num doente, devido a uma queda significativa do PEF. Os perfis celulares obtidos do esputo induzido e do lavado broncoalveolar foram distintos (p<0,05), com exceção dos eosinófilos, e não se verificaram correlações estatisticamente significativas entre os 2 métodos. Comparando os resultados do esputo com os valores de referência, verificou-se um aumento de linfócitos (3,2 vs. 0,5%) e eosinófilos (1,4 vs. 0,0%). Quando se compararam os resultados do esputo dos doentes com sarcoidose e pneumonite de hipersensibilidade, ambos os grupos apresentaram um aumento de linfócitos (4,4 vs. 3,9%) e a contagem de neutrófilos estava significativamente aumentada na pneumonite de hipersensibilidade (65,4 vs. 10,6%; p<0,05), achado também presente no lavado.
ConclusãoO esputo induzido é um método seguro e exequível nas DPI. Embora as contagens celulares obtidas não se correlacionem com as do lavado, os perfis celulares do esputo podem ajudar na distinção das diferentes DPI.
Induced sputum with hypertonic saline has been suggested as a safer and cheaper alternative to bronchoalveolar lavage for evaluation of patients with interstitial lung diseases (ILD).
ObjectiveTo evaluate the safety and feasibility of sputum induction in ILD and to compare sputum cellular profiles with paired bronchoalveolar lavage fluid results.
Material and methodsTwenty patients underwent sputum induction with 4.5% saline within 2 weeks of bronchoalveolar lavage. Total, differential cell counts and cellular viability were assessed. Wilcoxon test and Spearman's rank correlation coefficient were used and a p<0,05 was considered statistically significant.
ResultsFrom a total of 20 subjects (mean age 49.4±16.4 years, 70% male) a satisfactory sputum sample was obtained in 15 subjects (75%). Induction was stopped in one subject, due to a significant decrease in PEF. The cell profiles for induced sputum and bronchoalveolar lavage fluid (BALF) were different (P <.05), except for eosinophils, and there were no significant correlations between the two methods. Compared to sputum reference values there was an increase of lymphocytes (3.2% vs 0.5%) and eosinophils (1.4% vs 0.0%). Comparing sarcoidosis and hypersensitivity pneumonitis sputum, both diseases had an increase in lymphocytes (4.4 vs 3.9%), with a significant higher neutrophil count in hypersensitivity pneumonitis (65.4% vs 10.6% P <0.05), a finding also seen in BALF.
ConclusionInduced sputum is feasible and safe in interstitial lung diseases. Although sputum cellular counts are not correlated with bronchoalveolar lavage fluid, sputum cellular profiles may help to distinguish different ILD.
As doenças pulmonares intersticiais (DPI), também conhecidas como doenças pulmonares parenquimatosas difusas, constituem um grupo heterogéneo de doenças pulmonares com diferentes etiopatogenias, tratamento e prognóstico. Apesar de alguns dados sugerirem um aumento da prevalência e incidência das DPI nas últimas décadas, não existe qualquer estudo longitudinal de base populacional que avalie a evolução temporal dos subgrupos de DPI1.
Após a avaliação dos sinais e sintomas, das provas de função pulmonar e dos métodos de imagiologia torácica, métodos diretos mais invasivos como o lavado broncoalveolar (LBA), biópsia transbrônquica e/ou biópsia pulmonar cirúrgica são geralmente necessários para confirmar o diagnóstico2. O LBA é um método recomendado pela European Respiratory Society (ERS) e pela American Thoracic Society (ATS) para a avaliação diagnóstica dos doentes com DPI2. O LBA é útil no diagnóstico de DPI menos frequentes (por exemplo, patologias ocupacionais, doenças pulmonares eosinofílicas, histiocitose de células de Langerhans) e um importante meio auxiliar para o diagnóstico das principais DPI (por exemplo, sarcoidose, pneumonite de hipersensibilidade, fibrose pulmonar idiopática) na ausência de biópsia pulmonar. Na realidade, associando o tipo de padrão inflamatório encontrado no LBA com as manifestações clínicas e radiológicas, pode evitar-se a necessidade de biópsia e seus riscos inerentes3. Embora o LBA constitua uma técnica minimamente invasiva, com um risco diminuto para os doentes quando corretamente realizada, a adesão a este procedimento é um problema comum. Além disso, o LBA não é recomendado nem para programas de rastreio nem para a avaliação de exposições e follow-up, sendo mesmo contraindicado nalguns doentes3–6.
O esputo induzido (EI) pela inalação de solução hipertónica tem sido sugerido como uma alternativa ao LBA nalguns casos. É um método seguro, não-invasivo e reprodutível para a recolha de células e mediadores solúveis das vias aéreas7. Na última década, o EI foi reconhecido como um método muito útil na investigação e na prática clínica, fornecendo informação adicional para o diagnóstico, monitorização e previsão da resposta ao tratamento, particularmente nas doenças obstrutivas crónicas como a asma e a DPOC8–11. Existem algumas publicações sobre o uso do EI nas DPI3,5,12,13. Contudo, a sua segurança e utilidade nestas doenças é ainda incerta e controversa, sobretudo na sua capacidade de recolher amostras representativas dos eventos imunológicos e inflamatórios nas vias mais distais.
O objetivo primário deste estudo foi avaliar a segurança e a exequibilidade do EI e comparar os resultados obtidos com os valores de referência em doentes com DPI. Num subgrupo de doentes com alveolite linfocítica, comparamos o padrão celular do EI com o obtido no LBA.
Materiais e métodosSujeitosForam selecionados 20 doentes consecutivos da consulta de DPI a quem foi pedido EI. O procedimento foi explicado aos doentes, tendo estes sido estimulados a expetorar qualquer esputo após a inalação de solução salina a 4,5% por períodos de 5min. Se não fosse obtida uma amostra de esputo e se a função pulmonar se mantivesse superior a 80% em relação ao valor basal, o procedimento era continuado até ao máximo pré-definido de indução de 45min. A broncoscopia com colheita de LBA foi realizada 2 semanas antes do EI, como parte do procedimento clínico normal nestes doentes, de acordo com as recomendações internacionais e as publicações anteriores14,15. O diagnóstico final foi estabelecido por um pneumologista, com base nos resultados do LBA e nos achados clínicos, radiológicos, função respiratória e anatomia patológica. Todos os doentes deram o seu consentimento informado escrito e o estudo foi aprovado pela comissão de ética da Faculdade de Medicina da Universidade do Porto.
Indução e processamento do esputoA indução foi realizada através da inalação por peça bucal de solução salina a 4,5%, utilizando um nebulizador ultrassónico OMRON NE-U17 (Omron Healthcare Europe, Países Baixos) no seu débito máximo. A indução e o processamento foram realizados de acordo com as recomendações da ERS16,17, utilizando inalações de soro hipertónico por períodos de 5min. O débito expiratório máximo instantâneo (DEMI) pré e pós inalação de 200μg de salbutamol, foi registado utilizando o Mini-Wright Peak-Flow Meter (Clement-Clarke International; Harlow, Essex, Reino Unido). A indução foi interrompida quando o doente produziu uma quantidade adequada de esputo, quando o tempo máximo de 45min foi atingido ou caso o doente apresenta-se uma queda do DEMI abaixo de 80% do valor basal. Após a indução, foi selecionado todo o esputo livre de saliva e tratado com ditiotreitol (DTT, Sputolysin™ concentrada a 10%; Calbiochem Corporation, San Diego, CA, Estados Unidos da América) em solução salina fosfatada. A suspensão foi centrifugada e o botão celular ressuspenso e corado com azul-Trypan para análise da viabilidade celular e contagem celular total por miligrama de esputo processado. Foram preparadas lâminas por citocentrifugação e coradas com May-Grünwald Giemsa para a realização das contagens celulares diferenciais das células epiteliais brônquicas intactas e dos leucócitos, sendo contadas 500 células não escamosas. As amostras de esputo foram consideradas adequadas se contivessem <80% de células epiteliais escamosas, de contaminação salivar.
Processamento do lavado broncoalveolarA recolha do LBA foi realizada com fins diagnósticos utilizando um broncofibroscópio, de acordo com as recomendações da ERS15. Resumidamente, foram instilados 200ml de solução salina estéril no segmento do lobo médio em alíquotas de 50ml. Cada alíquota foi suavemente aspirada com uma seringa. Após a medição do volume total, o LBA foi filtrado através de uma gaze cirúrgica de dupla camada para remoção do muco. A primeira alíquota foi excluída. A contagem celular total foi realizada numa câmara celular de Neubauer e as contagens diferenciais em lâminas coradas com May-Grünwald-Giemsa.
Análise estatísticaOs dados são apresentados como medianas (P 25-75). Dado que as variáveis apresentavam uma distribuição não paramétrica foi utilizado o teste de Wilcoxon para comparar as diferenças nas contagens celulares diferenciais e dos subtipos celulares. As correlações entre os subtipos celulares obtidos com os métodos de diagnóstico (LBA e EI) foram avaliadas pelo coeficiente de correlação de Spearman. Um valor de p<0,05 foi considerado estatisticamente significativo.
ResultadosForam avaliados 20 indivíduos (média de idade 49,4±16,4 anos, 70% do sexo masculino) com DPI, 7 (35%) com sarcoidose, 8 (40%) com pneumonite de hipersensibilidade e um doente (5%) cada com fibrose pulmonar idiopática, pneumonia organizativa criptogénica, bronquiolite respiratória associada com DPI, síndrome de Churg-Strauss e silicose.
Foi obtida uma amostra de esputo adequada para o processamento em 15 (75%) dos doentes, com uma mediana de tempo de indução de 26,0 (21,0-33,5) minutos e uma variação do PEF após a indução de -5,9% (-8,9-0,0). Numa amostra não foi possível realizar a contagem celular devido a alterações morfológicas das células. Em 3 doentes não foi possível obter uma amostra de esputo adequada para o processamento (2 doentes com sarcoidose, um com pneumonite de hipersensibilidade) e um doente com sarcoidose não conseguiu produzir qualquer esputo após 45min de indução. A indução foi interrompida num doente devido a uma queda de 48% do PEF após 5min de indução.
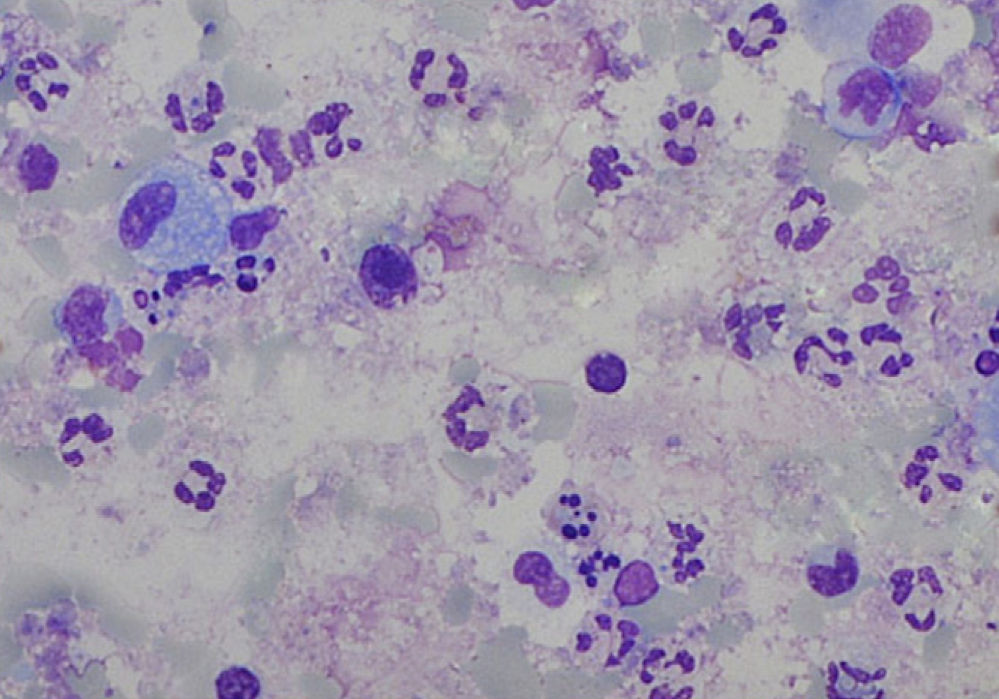
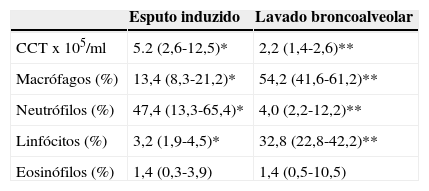
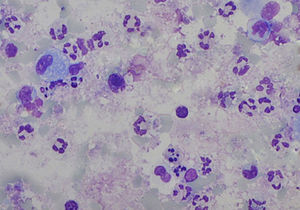
A análise das amostras de esputo satisfatórias revelou uma viabilidade celular de 55,0% (50,0-63,0), com uma contagem celular total de 5,2 (2,6-12,5)x105/ml e uma predominância de neutrófilos (fig. 1). As contagens celulares totais e diferenciais no EI e no LBA são apresentadas na tabela 1. Com a exceção dos eosinófilos, todas as contagens celulares são diferentes entre as 2 amostras (p<0,05). Quando comparados com os valores de referência do EI18, as nossas amostras apresentam contagem total de células (média de 1,8x106 cels/g vs. 2,4x106 cels/g) de neutrófilos (média 47,4%, esperado 36,7%) semelhantes, e um aumento da percentagem de linfócitos (média 3,2%, esperado 0,5%) e eosinófilos (média 1,4%, esperado 0,0%). De igual forma, comparando as nossas amostras de LBA com os valores de referência19 verificámos um aumento da percentagem de linfócitos (33,7 vs. < 15,0%) e eosinófilos (3,8 vs. < 0,5%) e ainda uma maior percentagem de neutrófilos (6,9 vs. < 3,0%).
Contagens celulares totais (CCT) e diferenciais no esputo induzido (EI) e lavado bronco-alveolar nos 15 casos com amostras satisfatórias de EI. Os resultados são apresentados como mediana (P 25-75). Com a exceção dos eosinófilos, todas as contagens celulares são significativamente diferentes entre as 2 amostras
| Esputo induzido | Lavado broncoalveolar | |
|---|---|---|
| CCTx105/ml | 5.2 (2,6-12,5)* | 2,2 (1,4-2,6)** |
| Macrófagos (%) | 13,4 (8,3-21,2)* | 54,2 (41,6-61,2)** |
| Neutrófilos (%) | 47,4 (13,3-65,4)* | 4,0 (2,2-12,2)** |
| Linfócitos (%) | 3,2 (1,9-4,5)* | 32,8 (22,8-42,2)** |
| Eosinófilos (%) | 1,4 (0,3-3,9) | 1,4 (0,5-10,5) |
*/** p<0,05, Wilcoxon.
Não foram encontradas correlações significativas entre as contagens celulares totais e diferenciais no esputo e LBA, com a exceção da percentagem de neutrófilos nos casos de pneumonite de hipersensibilidade (rs=0,9; p=0,05).
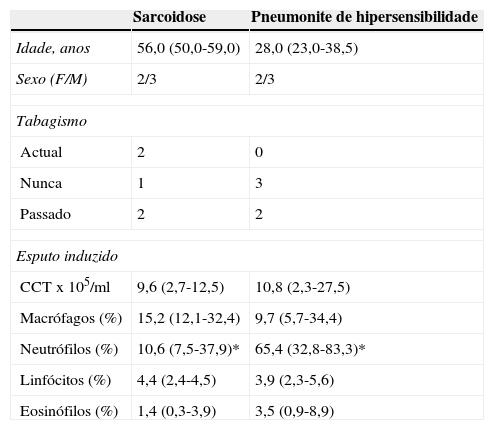
Na tabela 2 são apresentados os resultados da análise do EI em 2 subgrupos de doentes com alveolite linfocítica: sarcoidose e pneumonite de hipersensibilidade. Nestas patologias verificaram-se contagens celulares totais semelhantes (9,6 vs. 10,8x105/ml) e um aumento do número de linfócitos (4,4 vs. 3,9%). No entanto, nos resultados do EI foi detetado um aumento significativo da contagem de neutrófilos nas amostras de doentes com pneumonite de hipersensibilidade (65,4 vs. 10,6%; p<0,05) e um padrão semelhante foi observado nas amostras de LBA (9,2 vs. 2,8%; p<0,05).
Comparação das contagens celulares totais (CCT) e diferenciais no esputo induzido no subgrupo de doentes com sarcoidose (n=5) e pneumonite de hipersensibilidade (n=5). Os dados são expressos como mediana (P 25-75)
| Sarcoidose | Pneumonite de hipersensibilidade | |
|---|---|---|
| Idade, anos | 56,0 (50,0-59,0) | 28,0 (23,0-38,5) |
| Sexo (F/M) | 2/3 | 2/3 |
| Tabagismo | ||
| Actual | 2 | 0 |
| Nunca | 1 | 3 |
| Passado | 2 | 2 |
| Esputo induzido | ||
| CCTx105/ml | 9,6 (2,7-12,5) | 10,8 (2,3-27,5) |
| Macrófagos (%) | 15,2 (12,1-32,4) | 9,7 (5,7-34,4) |
| Neutrófilos (%) | 10,6 (7,5-37,9)* | 65,4 (32,8-83,3)* |
| Linfócitos (%) | 4,4 (2,4-4,5) | 3,9 (2,3-5,6) |
| Eosinófilos (%) | 1,4 (0,3-3,9) | 3,5 (0,9-8,9) |
*/* p<0,05, Mann-Whitney.
Neste estudo pretendemos avaliar a segurança e a exequibilidade do EI em DPI e comparar os perfis celulares obtidos com os do LBA em doentes recém-diagnosticados. Obtivemos amostras de esputo satisfatórias, permitindo o cálculo das contagens celulares diferenciais, em 15 doentes, e o procedimento foi bem tolerado (apenas um doente apresentou uma descida significativa do DEMI durante a indução).
Apesar de as contagens celulares totais e diferenciais das amostras de EI e LBA serem diferentes, confirmando que estes métodos recolhem amostras de compartimentos anatomicamente distintos (as vias aéreas centrais e as vias aéreas mais periféricas, respetivamente), os resultados deste estudo demonstram que, comparativamente com os valores de referência, se verifica um aumento do número de linfócitos e eosinófilos em ambos os métodos18,19. No subgrupo de doentes com pneumonite de hipersensibilidade a percentagem de neutrófilos no EI correlaciona-se significativamente com a do LBA. Adicionalmente, nestes doentes o número de neutrófilos no EI e no LBA encontra-se aumentado em comparação com os doentes com sarcoidose (tabela 2), outra patologia caracterizada pela presença de alveolite linfocítica.
Apesar de estar documentada a presença de hiperreatividade brônquica em doentes com DPI20 e de a inalação de soluções salinas hipertónicas poder induzir broncoconstrição e tosse21, neste estudo a indução do esputo revelou-se segura, corroborando os resultados de alguns estudos anteriores3,5. Apenas um doente apresentou broncoconstrição durante a indução (um doente de 63 anos, com suspeita de pneumonite de hipersensibilidade, enfisema pulmonar e um ligeiro aumento dos eosinófilos – 1,2% – no LBA).
Nesta série obtivemos uma amostra satisfatória em 15 (75%) dos sujeitos. Sobiecka et al.3 publicaram uma percentagem de sucesso global de 56% (33/59 em doentes com DPI), realçando, no entanto, um sucesso diferente entre patologias (7/7 nos doentes com fibrose pulmonar idiopática, 11/16 nas pneumonites de hipersensibilidade e 15/36 na sarcoidose). Estes resultados contrastam com os dados apresentados por D’Ippolito et al. que referem uma percentagem de sucesso de 100% na sarcoidose12 e pneumonite de hipersensibilidade13. Apesar destas publicações anteriores, no melhor do nosso conhecimento, não existe qualquer estudo anterior visando avaliar especificamente a segurança, exequibilidade e efeitos funcionais da indução de esputo nas DPI6. A análise das amostras obtidas revelou uma viabilidade celular ligeiramente inferior à encontrada em doentes saudáveis (55 vs. 72%), embora se mantenha dentro de limites aceitáveis22.
Com a exceção das contagens de eosinófilos, as contagens celulares totais e diferenciais foram diferentes entre o EI e o LBA, sugerindo que os métodos recolhem material de diferentes compartimentos pulmonares. Fireman et al.23 demonstraram através da realização de LBA segmentares a diferentes profundidades de via aérea, que a proporção de neutrófilos diminuí das vias aéreas centrais (20-30%) para as periféricas (< 2%), existindo um aumento da proporção de macrófagos, suportando a teoria de que o EI provém das vias aéreas centrais (rica em neutrófilos) e o LBA das vias aéreas mais distais e espaços alveolares. Em concordância com esta teoria e com outros estudos anteriores3,5,12,14,15, neste estudo encontramos uma percentagem significativamente superior de neutrófilos e inferior de macrófagos no EI em relação ao BAL. Tal como nos estudos de D’Ippolito et al.12,13, não encontramos correlações significativas entre a percentagem de linfócitos recuperadas com os 2 métodos. No entanto, se compararmos os resultados do EI com os valores de referência18, encontramos uma contagem celular total semelhante mas uma percentagem de linfócitos aumentada. A imunofenotipagem dos linfócitos no EI tem sido sugerida como um método auxiliar adicional útil para o diagnóstico e monitorização nas doenças pulmonares inflamatórias, como a sarcoidose. Fireman et al. referiram que um rácio CD4/CD8 > 2,5 no esputo apresenta um valor preditivo positivo de 82% para a distinção da sarcoidose de outras DPI não-granulomatosas. Moodley et al.14 e Sobiecka et al.3 relataram uma correlação significativa da relação CD4+/CD8+ no EI e LBA em doentes com sarcoidose, apesar de não existirem correlações significativas entre as contagens celulares diferenciais entre os 2 métodos. No nosso estudo também realizámos a análise por citometria de fluxo dos linfócitos do EI em alguns doentes com sarcoidose, e encontramos um rácio CD4+/CD8+ > 2,5 em 3 dos 4 casos avaliados (dados não apresentados).
Um achado interessante nesta pequena série foi a presença de contagens de neutrófilos superiores no EI e LBA nos casos de pneumonite de hipersensibilidade, em comparação com os de sarcoidose, existindo uma correlação significativa nestas contagens entre os 2 métodos. Este achado reflete, possivelmente, as características patológicas da pneumonite de hipersensibilidade, em que podem ser encontrados números aumentados de neutrófilos, em especial nas suas formas recorrentes24. No entanto, na nossa série, os 5 doentes incluídos apresentavam manifestações iniciais e evolução heterogéneas, sendo difícil estabelecer qualquer associação entre o aumento dos neutrófilos e o fenótipo da doença. Um doente tinha uma forma de apresentação aguda, 2 doentes uma forma sub-aguda e 2 formas crónicas. Além disso, apenas um doente apresentou um padrão de fibrose na tomografia pulmonar de alta resolução enquanto os restantes 4 apresentavam um padrão em mosaico e/ou vidro despolido. Em relação à evolução clínica, 3 doentes apresentaram regressão dos sintomas com corticoterapia e evicção do agente agressor, um doente uma forma crónica e outro teve uma deterioração progressiva, tendo falecido 2 anos após o diagnóstico.
Este estudo piloto apresenta algumas limitações que podem dificultar a generalização dos resultados. A primeira limitação deriva da heterogeneidade e pequena dimensão da amostra estudada, que dificultam a avaliação do papel do EI nas diferentes DPI, pelo que mais estudos, comparando os perfis inflamatórios encontrados no EI e LBA são necessários para esclarecer este assunto. No entanto, esta amostra permitiu-nos avaliar a exequibilidade e a segurança do EI nas DPI. Como segunda limitação, apontamos o facto de, apesar de termos demonstrado que o EI nas DPI é seguro e exequível, o procedimento requer bastante tempo para a realização e processamento, necessitando de suporte técnico especializado, o que limita o seu uso a centro especializados10.
A integração dos resultados do LBA com os achados clínicos, radiológicos, funcionais e anatomo-patológicos continua a constituir a metodologia «gold-standard» para a avaliação das DPI. No entanto, embora o LBA seja uma técnica minimamente invasiva, aportando um risco mínimo se executada de acordo com as normas, não pode ser efetuado em todos os doentes e é um método dispendioso e de utilização questionável no seguimento destes doentes. Neste estudo demonstramos que o EI é exequível e seguro neste grupo de doentes. Sendo um método menos dispendioso, menos invasivo e reprodutível no tempo, o EI é uma metodologia interessante para uso clínico e de investigação na abordagem das DPI22,25. Mais estudos são necessários para estabelecer qual o papel deste método promissor no diagnóstico e acompanhamento das DPI.
Conflito de interessesOs autores declaram não haver conflito de interesses.