A ausência de conversão dos exames micobacteriológicos direto e/ou cultural de expetoração após 2 meses de tratamento para a tuberculose (TB) tem sido considerado um preditor do grau de infeciosidade do doente e de falência terapêutica. Os autores estabeleceram por objetivo a identificação dos fatores associados com a conversão tardia dos exames direto e cultural de expetoração num grupo de doentes com TB pulmonar sob tratamento antibacilar.
Material e métodosCoorte retrospetiva de 136 doentes adultos com TB pulmonar, confirmada por exame cultural de expetoração, referenciados a um Centro de Diagnóstico Pneumológico urbano. Foram analisadas variáveis sócio-demográficas, clínicas, radiológicas, microbiológicas e relacionadas com a terapêutica.
ResultadosA mediana de idades foi 41,0 (intervalo interquartil [IIQ] 18,0) anos e 75,0% dos doentes eram do género masculino. A conversão tardia dos exames de expetoração direto e cultural ocorreu em 25,4% (30/118) e 27,2% (37/136) dos doentes, respetivamente. Pela análise multivariada, a idade ≥ 50 anos (odds ratio [OR] 4,4, intervalo de confiança [IC] 95% 1,5-13,3), o género masculino (OR 10,8, IC 95% 1,3-91,1), e a carga bacilar > 1-9 bacilos álcool-ácido resistentes (BAAR)/campo (3+) (OR 11,7, IC 95% 1,4-100,6) estiveram significativamente associados com a positividade persistente do exame direto, após 2 meses de tratamento. O envolvimento radiológico bilateral (OR 3,7, IC 95% 1,5-9,0) e a contagem de colónias > 100 (3+) (OR 5,8, IC 95% 1,2-27,4) estiveram significativamente associados com a positividade persistente do exame cultural.
ConclusõesA conversão tardia dos exames direto e cultural de expetoração ocorreu em cerca de um terço dos doentes. A idade mais avançada, o género masculino e a elevada carga bacilar estiveram independentemente associados com a conversão tardia do exame direto de expetoração. O envolvimento radiológico bilateral e a contagem de colónias mais elevada estiveram independentemente associados com a conversão tardia do exame cultural.
Failure of sputum smear and/or culture conversion after 2 months of tuberculosis (TB) treatment has been considered a predictor of patient infectivity and treatment failure. We aimed to identify the factors associated with delayed sputum smear and culture conversion in patients with pulmonary TB who were given anti-TB treatment.
Material and methodsRetrospective cohort of 136 adult patients with sputum culture-proven pulmonary TB referred to an urban Chest Disease Centre. Socio-demographic, clinical, radiological, microbiological, and therapeutic data were evaluated.
ResultsThe median age was 41.0 (interquartile range [IQR] 18.0) years and 75.0% of patients were male. Delayed sputum smear and culture conversion occurred in 25.4% (30/118) and 27.2% (37/136) of patients, respectively. Multivariate analysis indicated that age ≥ 50 years (odds ratio [OR] 4.4, 95% confidence interval [CI] 1.5-13.3), male gender (OR 10.8, 95% CI 1.3-91.1), and smear grade > 1-9 acid fast bacilli (AFB)/field (3+) (OR 11.7, 95% CI 1.4-100.6) were significantly associated with persistent smear positivity after 2 months of treatment. Bilateral radiological involvement (OR 3.7, 95% CI 1.5-9.0) and colony count > 100 (3+) (OR 5.8, 95% CI 1.2-27.4) were significantly associated with persistent culture positivity.
ConclusionsDelayed sputum smear and culture conversion occurred in about one third of patients. Older age, male gender, and higher bacillary load were independently associated with delayed smear conversion. Bilateral radiological involvement and higher colony count were independently associated with delayed culture conversion.
O sucesso do controlo da tuberculose (TB) depende de uma prevenção precoce e eficaz da transmissão do Mycobacterium tuberculosis (MT) a partir de doentes infeciosos. A esterilização da expetoração constitui um ponto cardinal para o sucesso terapêutico e baixa infeciosidade do doente, sendo usada para melhor determinar o tempo de duração do isolamento da via aérea em contexto hospitalar e de ambulatório. Nos países de maiores recursos, a documentação da conversão do exame cultural é atualmente recomendada antes do término do tratamento antibacilar1,2. Apesar da discordância entre os resultados dos exames direto e cultural (abaixo referida), o exame direto é mais rápido, simples e económico do que o cultural, sendo por isso largamente utilizado para o diagnóstico e a monitorização terapêutica em áreas de recursos mais limitados1.
Alguns estudos reportaram que o número de bacilos álcool-ácido resistentes (BAAR) diminui rapidamente após o início da terapêutica e que 80-85% dos doentes com TB tornam-se não infeciosos cerca de 2 semanas depois3–5. Contudo, Wang et al.6 estimou que mais de 50% dos doentes com TB provavelmente mantêm-se contagiosos após 2 semanas de tratamento. Tal salienta a importância de uma monitorização regular do resultado dos exames direto e cultural de expetoração até à obtenção de 3 amostras negativas consecutivas de forma a estabelecer o tempo necessário para o isolamento respiratório e providenciar a proteção adequada dos contactos não infetados, situação já reportada previamente por Clancy7. Estudos epidemiológicos indicaram que a proporção de doentes com TB que permanecem com exames diretos de expetoração positivos após 2 meses de tratamento pode ser superior a 20% (3,3-25,3%)6–13. Outros estudos indicam que a ausência de conversão do exame direto e/ou cultural ao 2° mês de tratamento constitui um preditor de infeciosidade do doente e da falência do tratamento6,8–11,14. Portanto, a identificação dos seus fatores de risco é muito importante para as políticas de controlo da TB e alocação dos recursos de saúde pública. Muitos estudos6,13,15–18 revelaram que o género masculino, a diabetes mellitus, o tabagismo, a doença radiológica extensa, a cavitação, a carga bacilar, bem como outros fatores aumentam o risco de infeciosidade da TB. Contudo, alguns dos resultados destes estudos eram inconsistentes devido a diferenças metodológicas, como a aplicação da conversão do exame direto em detrimento do exame cultural. Em particular, de acordo com investigações prévias, pode haver uma discordância entre os resultados dos exames direto e cultural aos 2 meses, e cerca de 30% dos doentes com TB com negativação do exame cultural permanecem com exame direto positivo19–21. Tal deve-se à presença de BAAR não viáveis, colonização por micobactérias não tuberculosas, ou resultados falso-positivos19–21. Uma revisão sistemática e meta-análise recente realizada por Horne et al. concluiu que tanto o exame direto quanto o cultural têm baixa sensibilidade e especificidade para outcomes como falência terapêutica e recidiva22. Esta posição foi argumentada por alguns autores23 no que se refere a questões metodológicas, contudo, Su et al. demonstrou que o limitado valor preditivo do exame direto aos 2 meses para a conversão da cultura era devido ao significativo impacto clínico de alguns fatores, para além do estado do exame direto, como cavitação, resistência à rifampicina, e aplicação da terapêutica observada diretamente (TOD)24.
O desaparecimento de BAAR dos exames direto e cultural consiste no determinante mais amplamente aceite do tempo de isolamento e tratamento de doentes com TB, apesar de alguma precaução e juízo clínico deverem ser aplicados na interpretação dos seus resultados, sobretudo relativamente ao exame direto. O presente estudo foi elaborado de forma a determinar o tempo de conversão dos exames direto e cultural e a identificar os potenciais preditores de conversão tardia dos mesmos em doentes com TB pulmonar.
Material e métodosDesenho do estudo e populaçãoCoorte retrospetiva de doentes adultos com o diagnóstico de TB pulmonar, confirmado por exame cultural de expetoração, referenciados a um Centro de Diagnóstico Pneumológico urbano (Vila Nova de Gaia, Portugal), entre janeiro de 2006 a junho de 2009.
Dados sócio-demográficos, clínicos, microbiológicos, radiológicos e relacionados com a terapêutica foram obtidos através dos processos dos doentes e das bases do Plano Nacional de Luta contra a Tuberculose.
Foram estabelecidos como critérios de exclusão: multirresistência, incapacidade de obter expetoração para análise, abandono, transferência para outra instituição, ou morte durante o tratamento.
Exames micobacteriológicos de expetoração – direto e culturalA análise do exame direto para deteção de BAAR foi feita por microscopia de fluorescência e/ou coloração de Ziehl-Neelsen e a respetiva quantificação por categorias padrão e equivalentes: 1-9 BAAR/100 campos (1+); 1-9 BAAR/10 campos (2+); 1-9 BAAR/campo (3+); e > 9 BAAR/campo (4+)25,26.
As amostras foram cultivadas em meio líquido BACTEC MGIT 960 (Becton Dickinson) e/ou em meio sólido Lowenstein-Jensen (Bio-Rad) e a quantificação do número de colónias foi realizada da seguinte forma: < 10 colónias (1+); 10-100 colónias (2+); > 100 colónias (3+); e confluência (4+), de acordo com os critérios laboratoriais de referência. Todas as primeiras culturas positivas foram submetidas a estes de identificação do MT e testes de sensibilidade aos antimicrobianos (TSA) (método da concentração inibitória mínima).
Características radiológicasAs telerradiografias torácicas foram caracterizadas de acordo com extensão da doença (unilateral, bilateral) e presença de cavitação.
Tratamento e monitorizaçãoO esquema terapêutico clássico com duração de 6 meses, de acordo com os consensos internacionais, foi aplicado (fase inicial (2 meses): isoniazida (H), rifampicina (R), pirazinamida (Z), e etambutol (E), diariamente; fase de continuação (4 meses): H e R diariamente), e alterado nos doentes com doença hepática e/ou renal concomitante, na presença de efeitos adversos, e de acordo com os resultados do TSA, se necessário. A estratégia terapêutica TOD foi assegurada durante todo o período de tratamento. Os exames direto e cultural de expetoração foram realizados no início, aos 2 meses, e no fim do tratamento. Contudo, o exame direto foi realizado a cada 2 semanas até à obtenção de 3 amostras negativas consecutivas e o exame cultural mensalmente até à obtenção de 2 amostras negativas consecutivas27.
DefiniçõesA conversão do exame direto foi definida na presença de 3 amostras negativas consecutivas. O tempo de conversão dos exames direto e cultural foi calculado desde a data de início de tratamento até à data da primeira amostra negativa. A conversão tardia dos exames direto e cultural foi definida perante a positividade persistente desses exames após 2 meses de tratamento antibacilar.
Análise estatísticaA análise estatística foi feita através do programa SPSS versão 17 (SPSS Inc., Chicago, Illinois, USA). Todas as probabilidades foram bicaudais e os valores de p < 0,05 foram considerados significativos.
Os dados foram descritos em mediana e intervalo interquartil (IIQ) para as variáveis quantitativas (distribuição não normal) e como contagens e proporções para as variáveis qualitativas. A comparação de variáveis quantitativas foi feita através do teste Mann-Whitney. O teste Qui-quadrado ou teste exato de Fisher foram usados para comparar variáveis categóricas sempre que apropriado.
A conversão tardia dos exames direto e cultural foi considerada uma variável dicotómica dependente. As variáveis com significado estatístico e com significado biológico plausível na análise univariada foram introduzidas num modelo de regressão logística (método forward stepwise) de forma a identificar os fatores independentemente associados com o outcome de conversão tardia. Os odds ratios (OR) e intervalos de confiança de 95% (IC 95%) foram determinados.
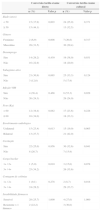
ResultadosForam analisados retrospetivamente um total de 136 doentes. A mediana de idades foi 41,0 (IIQ 18,0) anos, e 75,0% dos doentes eram do género masculino. As características sócio-demográficas e as co-morbilidados dos doentes incluídos estão representadas na tabela 1. Todos os doentes tinham TB pulmonar confirmada por exame cultural de expetoração e 118 doentes (86,8%) apresentavam simultaneamente exame direto positivo.
Características sócio-demográficas e co-morbilidades da população
| Características | Todos os doentes (n = 136) |
|---|---|
| Idade (anos) | 41,0 (IIQ 18,0) |
| Género, n (%) | |
| Feminino / Masculino | 34 (25,0) / 102 (75,0) |
| Desemprego, n (%) | |
| Sim / Não | 50 (36,8) / 86 (63,2) |
| Imigrante, n (%) | |
| Sim / Não | 6 (4,4) / 130 (95,6) |
| Reclusão, n (%) | |
| Sim / Não | 2 (1,5) / 134 (98,5) |
| Sem-abrigo, n (%) | |
| Sim / Não | 6 (4,4) / 130 (95,6) |
| Residência comunitária, n (%) | |
| Sim / Não | 3 (2,2) / 133 (97,8) |
| Tabagismo ativo, n (%) | |
| Sim / Não | 75 (72,8) / 28 (27,2) |
| Alcoolismo, n (%) | |
| Sim / Não | 21 (15,4) / 115 (84,6) |
| Utilizadores de drogas, n (%) | |
| Sim / Não | 15 (11,0) / 121 (89,0) |
| Infeção pelo VIH, n (%) | |
| Sim / Não | 15 (11,0) / 121 (89,0) |
| DM, n (%) | |
| Sim / Não | 10 (7,4) / 126 (92,6) |
| Neoplasia, n (%) | |
| Sim / Não | 5 (3,7) / 131 (96,3) |
| TB prévia, n (%) | |
| Sim / Não | 12 (8,8) / 124 (91,2) |
| Peso, n (%) | |
| < 60 Kg / ≥ 60 Kg | 72 (57,1) / 54 (42,9) |
As variáveis quantitativas são expressas em mediana e intervalo interquartil (IIQ).
DM: diabetes mellitus; TB: tuberculose;VIH: vírus da imunodeficiência humana.
O tempo mediano de conversão dos exames direto e cultural foi 46 (1-343) dias e 46 (1-127) dias, respetivamente. Após 2 meses de tratamento, 25,4% (30/118) e 27,2% (37/136) dos doentes permaneciam com exame direto e cultural positivo, respetivamente. Entre os 30 doentes com conversão tardia do exame direto, 6 atingiram conversão do exame cultural aos 2 meses. Na tabela 2 estão representados alguns dados dos doentes incluídos relacionados com a TB.
Características da TB e tratamento antibacilar
| Características | Todos os doentes (n = 136) |
|---|---|
| TB pulmonar / extra-pulmonar, n (%) | 128 (94,1) / 8 (5,9) |
| Envolvimento radiológico, n (%) | |
| Unilateral / Bilateral | 79 (61,2) / 50 (38,8) |
| Cavitação, n (%) | |
| Sim / Não | 92 (67,6) / 44 (32,4) |
| Carga bacilar, n (%) | |
| 1-9 BAAR/100 campos (1+) | 6 (6,5) |
| 1-9 BAAR/10 campos (2+) | 14 (15,0) |
| 1-9 BAAR/campo (3+) | 24 (25,8) |
| > 9 BAAR/campo (4+) | 49 (52,7) |
| Contagem de colónias, n (%) | |
| < 10 (1+) | 8 (7,3) |
| 10-100 (2+) | 15 (13,8) |
| > 100 (3+) | 27 (24,8) |
| confluência (4+) | 59 (54,1) |
| Teste sensibilidade antimicrobiana, n (%) | |
| Sensível | 126 (92,7) |
| Resistência à isoniazida | 1 (0,7) |
| Resistência à estreptomicina | 7 (5,1) |
| Resistência à isoniazida e estreptomicina | 2 (1,5) |
| Toxicidade terapêutica, n (%) | |
| Sim / Não | 17 (14,4) / 101 (85,6) |
BAAR: bacilos álcool-ácido resistentes;TB: tuberculose.
O género masculino [55,0 (IIQ 53,0) dias vs 34,0 (IIQ 24,5) dias; p = 0,028], o tabagismo ativo [54,0 (IIQ 48,0) dias vs 28,0 (IIQ 33,5) dias; p = 0,004], e as cargas bacilares mais elevadas [1+: 24,0 (IIQ 14,0) dias vs 2+: 35,0 (IIQ 36,3) dias vs 3+: 53,0 (IIQ 54,5) dias vs 4+: 62,0 (IIQ 62,5) dias; p = 0,001] estiveram associados a um maior tempo de conversão do exame direto.
Pela análise univariada, o risco de um exame direto permanecer positivo aos 2 meses de tratamento foi superior nos doentes com idade ≥ 50 anos, do género masculino, e com carga bacilar > 3+ (tabela 3). Não foram encontradas diferenças estatisticamente significativas relativamente às outras variáveis analisadas, nomeadamente, imigração, reclusão, sem-abrigo, residência comunitária, hábitos alcoólicos e toxifílicos, diabetes mellitus, neoplasias, TB prévia, extensão TB (pulmonar ou extra-pulmonar), tratamento antibacilar alternativo, e toxicidade terapêutica.
Fatores associados com a conversão tardia dos exames micobacteriológicos direto e cultural de expetoraçãoa (análise univariada)
| Conversão tardia exame direto | Conversão tardia exame cultural | |||
|---|---|---|---|---|
| n (%) | Valor p | n (%) | Valor p | |
| Idade (anos) | ||||
| < 50 | 15 (17,9) | 0,003 | 24 (25,0) | 0,371 |
| ≥ 50 | 15 (44,1) | 13 (32,5) | ||
| Género | ||||
| Feminino | 2 (6,9) | 0,008 | 7 (20,6) | 0,317 |
| Masculino | 28 (31,5) | 30 (29,4) | ||
| Desemprego | ||||
| Sim | 14 (29,2) | 0,439 | 19 (38,0) | 0,031 |
| Não | 16 (22,9) | 18 (20,9) | ||
| Tabagismo ativo | ||||
| Sim | 21 (30,9) | 0,065 | 25 (33,3) | 0,124 |
| Não | 3 (12,0) | 5 (17,9) | ||
| Infeção VIH | ||||
| Sim | 4 (36,4) | 0,468 | 8 (53,3) | 0,028 |
| Não | 26 (24,3) | 29 (24,0) | ||
| Peso (Kg) | ||||
| < 60 | 12 (19,4) | 0,082 | 17 (23,6) | 0,228 |
| ≥ 60 | 16 (34,0) | 18 (33,3) | ||
| Envolvimento radiológico | ||||
| Unilateral | 15 (23,4) | 0,613 | 15 (19,0) | 0,005 |
| Bilateral | 13 (27,7) | 21 (42,0) | ||
| Cavitação | ||||
| Sim | 22 (25,0) | 0,856 | 30 (32,6) | 0,041 |
| Não | 8 (26,7) | 7 (15,9) | ||
| Carga bacilar | ||||
| 1+ / 2+ | 1 (5,0) | 0,010 | 3 (15,0) | 0,078 |
| 3+ / 4+ | 25 (34,2) | 26 (35,6) | ||
| Contagem de colónias | ||||
| 1+ / 2+ | 1 (9,1) | 0,278 | 2 (8,7) | 0,018 |
| 3+ / 4+ | 24 (28,2) | 29 (33,7) | ||
| Sensibilidade fármacos | ||||
| Sensível | 28 (25,7) | 1,000 | 4 (27,0) | 1,000 |
| Resistente > 1 fármaco | 2 (22,2) | 3 (30,0) | ||
VIH: vírus da imunodeficiência humana.
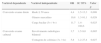
A análise de regressão logística multivariada indicou que todas estas 3 variáveis significativas na análise univariada estavam independentemente associadas com a conversão tardia do exame direto (idade ≥ 50 anos: OR 4,4, IC 95% 1,5-13,3; género masculino: OR 10,8, IC 95% 1,3-91,1; carga bacilar > 3+: OR 11,7, IC 95% 1,4-100,6) (tabela 4).
Regressão logística multivariada das variáveis significativamente associadas com a conversão tardia dos exames micobacteriológicos direto e cultural da expetoração
| Variável dependente | Variável independente | OR | IC 95% | Valor p |
|---|---|---|---|---|
| Conversão exame direto | Idade ≥ 50 anos | 4,4 | 1,5-13,3 | 0,008 |
| Género masculino | 10,8 | 1,3-91,1 | 0,029 | |
| Carga bacilar (3+ / 4+) | 11,7 | 1,4-100,6 | 0,025 | |
| Conversão exame cultural | Envolvimento radiológico bilateral | 3,7 | 1,5-9,0 | 0,005 |
| Contagem de colónias (3+ / 4+) | 5,8 | 1,2-27,4 | 0,027 |
OR: odds ratio; IC 95%: intervalo de confiança de 95%.
O desemprego [56,0 (IIQ 55,0) dias vs 41,5 (IIQ 46,3) dias; p = 0,046], o tabagismo ativo [58,0 (IIQ 47,0) dias vs 33,5 (IIQ 40,3) dias; p = 0,022], o envolvimento radiológico bilateral [59,5 (IIQ 64,8) dias vs 41,0 (IIQ 43,0) dias; p = 0,011], a doença cavitária [57,0 (IIQ 49,8) dias vs 35,0 (IIQ 42,3) dias; p = 0,006], e as contagens de colónias mais elevadas [1+: 20,5 (IIQ 28,5) dias vs 2+: 27,0 (IIQ 26,0) dias vs 3+: 39,0 (IIQ 33,0) dias vs 4+: 66,0 (IIQ 54,0) dias; p < 0,001] estiveram associadas a um maior tempo de conversão do exame cultural.
Pela análise univariada, o risco de um exame cultural permanecer positivo aos 2 meses de tratamento foi superior nos doentes desempregados, com infeção pelo vírus da imunodeficiência humana (VIH), com envolvimento radiológico bilateral, doença cavitária, e com contagem de colónias > 3+ (tabela 3).
A análise de regressão logística multivariada revelou que só o envolvimento radiológico bilateral (OR 3,7, IC 95% 1,5- 9,0) e a contagem de colónias > 3+ (OR 5,8, IC 95% 1,2-27,4) estavam independentemente associados com a conversão tardia do exame cultural (tabela 4).
DiscussãoUma monitorização regular dos exames micobacteriológicos direto e cultural de expetoração durante o tratamento antibacilar permite avaliar a conversão desses exames, evento importante para o planeamento terapêutico e aconselhamento dos doentes com TB28, sobretudo nos países com incidência intermédia de TB, como Portugal29.
No presente estudo, os autores analisaram, de forma independente, os resultados dos exames direto e cultural de doentes com TB pulmonar. Os tempos medianos de conversão dos exames direto e cultural foram superiores a um mês, apesar dos respetivos intervalos serem amplos e variáveis podendo demonstrar a influência de diferentes fatores. O tabagismo ativo e a carga bacilar global (representada através da quantificação do número de BAAR e contagem de colónias) estiveram associadas a um maior tempo de conversão para ambos os exames. O género masculino esteve associado a um tempo de conversão do exame direto maior e o desemprego, o envolvimento radiológico bilateral, e a doença cavitária estiveram associados a tempo de conversão do exame cultural maior. O intervalo do tempo de conversão do exame direto foi superior ao do exame cultural, provavelmente devido à presença de bacilos não viáveis20,24.
Os resultados deste estudo revelaram uma conversão tardia dos exames direto e cultural em 25,4% e 27,2% dos doentes com TB, respetivamente. Estudos previamente realizados relataram tempos de conversão variados entre os doentes com TB, o que está relacionado com diferenças geográficas, estado inicial do exame direto, metodologias e análise estatística aplicadas6,8–16,18,24,30–32. No presente estudo, a conversão tardia do exame direto esteve independentemente associada a uma idade superior a 50 anos, ao género masculino, e a uma carga bacilar pré-tratamento elevada.
Estudos prévios demonstraram que a ausência de conversão do exame direto é mais frequente nos doentes mais idosos11,15,18,33,34, situação explicada pela maior incidência de limitações físicas, clearance ineficaz dos bacilos devido a uma resposta imunológica mais deficitária, e atraso no acesso ao diagnóstico e tratamento neste grupo de doentes. Potencialmente, algumas das suas co-morbilidades, como as que possam afetar a absorção e metabolismo de determinados fármacos antibacilares, podem também desempenhar um papel.
Os estudos relativos ao efeito do género na conversão da expetoração são contraditórios. No presente estudo, os autores verificaram que o género masculino esteve associado a conversão tardia do exame direto. Estes resultados estão de acordo com os apresentados por Rekha et al., que especulou que tal estava relacionado com a maior prevalência de hábitos alcoólicos e tabágicos nos homens18. Contudo, no presente estudo, não foi encontrado qualquer efeito do género no consumo de álcool e de tabaco (dados não apresentados).
Os doentes com cargas bacilares pré-tratamento superiores (3+/4+) negativaram menos frequentemente em comparação com os doentes com cargas bacilares inferiores (1+/2+). Estudos prévios reportaram resultados semelhantes6,8,11,35. Rieder mostrou que a conversão do exame direto aos 2 meses foi 90,9%, 77,9%, e 61,7% nos doentes com carga bacilar inicial baixa, moderada, e intensa, respetivamente8. Outros estudos também demonstraram que a positividade persistente do exame direto esteve associada a graus mais elevados de BAAR pré-tratamento reflexo de uma carga inicial de micobactérias elevada36,37.
A análise univariada mostrou que a positividade do exame cultural aos 2 meses esteve associada com o desemprego, a infeção pelo VIH, o envolvimento radiológico bilateral, a cavitação e contagem de colónias mais elevada. Contudo, a análise multivariada mostrou que só o envolvimento radiológico bilateral e as contagens de colónias mais elevadas estiveram independentemente relacionadas com esse resultado.
Nos doentes com TB desempregados, o consumo de álcool, de tabaco e a infeção pelo VIH foram mais frequentes (dados não apresentados), os quais poderiam constituir potenciais confundidores. A evidência prévia mostrou que os fumadores ativos e passivos apresentam maior risco de contrair TB ativa comparativamente com os não fumadores38–41, contudo os dados sobre a associação entre tabagismo e outros outcomes, como a conversão do exame cultural, ainda são insuficientes38–41. A análise univariada revelou que a infeção pelo VIH esteve associada com a conversão tardia do exame cultural, contudo o estado de infeção pelo VIH não constituiu um resultado significativo na análise multivariada. Tal está de acordo com alguns estudos anteriores que mostraram que o estado de infeção pelo VIH não influencia negativamente a conversão do exame cultural, na medida em que a sua positividade tem sido associada a uma carga bacilar inferior, expressa, tal como no presente estudo, por uma baixa prevalência de doença cavitária neste grupo de doentes (dados não apresentados)18,30,33,35,42.
O envolvimento radiológico bilateral e uma contagem de colónias elevada constituíram fatores de risco independentes para a conversão tardia do exame cultural, devido à elevada carga bacilar basal destes doentes. Contrariamente a outros estudos6,11,24,28, os presentes resultados não revelaram qualquer relação entre a presença de cavitação e a conversão tardia dos exames direto e cultural de expetoração, apesar da mesma estar significativamente associada a um maior tempo de conversão do exame cultural. Esta discrepância pode ter estado relacionada com diferenças metodológicas e relacionadas com as populações, o reduzido tamanho da amostra, e/ou o desenho retrospetivo do estudo.
Neste estudo, os fatores que influenciaram a conversão dos exames direto e cultural foram diferentes. Consequentemente, pode-se especular sobre a importância de avaliar separadamente cada tipo de exame micobacteriológico. Su et al. realizou uma análise prospetiva que incluiu 371 doentes com TB e mostrou que o valor preditivo do exame direto aos 2 meses na conversão do exame cultural era limitado devido à considerável influência de fatores clínicos, como exame direto inicial, cavitação, resistência à rifampicina, multirresistência, e TOD24. À semelhança, nem todos os doentes do presente estudo apresentaram simultaneamente conversão tardia dos exames direto e cultural.
O conhecimento dos fatores de risco associados a uma conversão tardia do exame cultural permite a identificação dos doentes altamente infeciosos, os quais necessitam de mais recursos médicos e maior tempo de isolamento respiratório, para além de necessitarem de uma interpretação cautelosa dos exames diretos de expetoração. Consequentemente, alguns autores22,24 advogam o uso de uma nova medida, como um biomarcador de elevada precisão e de resultado imediato, contrariamente ao exame cultural, para avaliação da resposta ao tratamento e grau de infeciosidade durante o tratamento antibacilar.
As principais limitações do presente estudo são o seu pequeno tamanho amostral, o seu desenho retrospetivo, com a consequente falta de alguns dados e avaliação subjetiva de algumas características. Os autores tentaram minimizar tais limitações através de uma revisão cuidadosa de todos os ficheiros clínicos e resultados de exames auxiliares de diagnóstico disponíveis.
Em conclusão, a conversão tardia dos exames direto e cultural de expetoração ocorreu em cerca de um terço dos doentes. A idade avançada, o género masculino, e uma carga bacilar mais elevada estiveram independentemente associados com a conversão tardia do exame direto; o envolvimento radiológico bilateral e uma contagem de colónias mais elevada estiveram independentemente associados com a conversão tardia do exame cultural. Os autores sugerem que a intensificação do tratamento e medidas adequadas de precaução de transmissão do MT devem ser especialmente aplicadas nos doentes com TB e estes fatores de risco, permitindo a optimização das medidas nacionais de controlo da TB.
Conflitos de interessesOs autores declaram não haver conflito de interesses.