Avaliar a prevalência da Síndrome de Apneia-Hipopneia do Sono (SAHS) em doentes internados na Unidade de Cuidados Intensivos Coronários (UCIC); determinar factores clínicos preditivos de SAHS; comparar os resultados obtidos com o estudo de sono simplificado (ESS) com os da polissonografia (PSG).
MétodosEstudo prospectivo de doentes internados na UCIC com Síndrome Coronária Aguda (SCA), confirmado por coronariografia. Foram avaliados dados demográficos e antropométricos, factores de risco cardiovascular e valores da escala de sonolência de Epworth. O ESS foi realizado com ApneaLinkTM durante o internamento ou após a alta. Os doentes com índice de apneia-hipopneia (IAH) ≥ 10/h foram convidados a realizar PSG.
ResultadosDurante 4 meses foram seleccionados consecutivamente 91 doentes com SCA. Cinquenta e oito doentes completaram o estudo, sendo 43 (74,1%) do sexo masculino, média etária de 61,7±12,2 anos e índice de massa corporal médio de 27,4±3,5kg/m2. A mediana de tempo para realização do ESS foi de 17,5 dias. O estudo foi compatível com SAHS em 25 casos (43,1%). Aos doentes com IAH ≥ 10/h no ESS foi proposta a realização de PSG e ESS em simultâneo. A mediana do tempo entre SCA e a PSG foi de 30 dias. A PSG confirmou a positividade de todos os casos detectados pelo ESS.
ConclusãoNo nosso estudo detectámos uma elevada prevalência de SAHS em doentes com SCA internados na UCIC (43,1%). Os resultados suportam a necessidade de um método de rastreio da SAHS em doentes internados com SCA. O ESS pode ter um papel importante no rastreio da SAHS nesta população.
To evaluate the prevalence of Sleep Apnea-Hypopnea Syndrome (SAHS) in patients who were admitted with Acute Coronary Syndrome (ACS) to the Coronary Care Unit (CCU) and the clinical predictors of SAHS in patients with ACS and to compare the results of the simple sleep test (SST) with polysomnography (PSG).
MethodsThis was a prospective study that included patients who were admitted to the CCU with ACS, which was confirmed by coronary angiography. Demographic and anthropometric data, cardiovascular risk factors and measures on the Epworth Sleepiness Scale were collected. The SST was conducted with the ApneaLinkTM device during hospitalization or after discharge. Patients with an apnea-hypopnea index (AHI) ≥ 10/h were invited to participate in PSG.
ResultsNinety-one patients with ACS were consecutively included over 4 months. Of the fifty-eight patients who completed the study 43 (74.1%) were male. The mean age was 61.7±12.2 years, and the mean body mass index was 27.4±3.5kg/m2. The median time for SST performance was 17.5 days. This study was compatible with SAHS in 25 cases (43.1%). Patients who had an AHI ≥ 10/h in the SST were submitted to PSG and SST simultaneously. The median interval between the ACS and the execution of PSG was 30 days. PSG confirmed that all of the cases that were detected by SST were positive.
ConclusionIn our study, we found a high prevalence of SAHS in patients who were admitted to the CCU with ACS (43.1%). These results support the need for SAHS screening in patients who are hospitalized with ACS. The SST may have a role in the screening of SAHS in this population.
A Síndrome de Apneia-Hipopneia do Sono (SAHS) é um importante problema de saúde pública não só pela sua associação a hipersonolência, acidentes de viação, morbilidade cardiovascular, alterações cognitivas, ansiedade, depressão e alterações metabólicas, como também pela sua elevada prevalência1,2. Segundo os clássicos estudos de Young, 2-4% da população adulta tem SAHS3, embora os últimos estudos apontem que entre 3,7% e 26% da população tem um índice de apneia-hipopneia (IAH) superior a 5 eventos por hora1. Se considerarmos um IAH > 5/h e a presença de hipersonolência, a prevalência estimada para SAHS é de 1,2-7,5%1.
A cardiopatia isquémica, nomeadamente a Síndrome Coronária Aguda (SCA) representa, também, um grave problema devido à sua elevada prevalência, complicações associadas e mortalidade. Vários estudos têm demonstrado uma associação independente entre SAHS e SCA, sugerindo que a SAHS deve ser tida em conta como um factor de risco a considerar em doentes com SCA4–6.
As alterações observadas na SAHS, nomeadamente, a hipoxémia intermitente, a acidose e a vasoconstrição simpática, podem originar stress hemodinâmico, que tem particular importância em doentes com doença coronária, podendo originar isquémia do miocárdio ou angina nocturna6–9.
A maioria dos doentes com SAHS permanecem sem diagnóstico e sem tratamento10–12, podendo isto ser particularmente importante em doentes com patologia cardiovascular, que poderiam beneficiar do diagnóstico para minimizar o risco de novos eventos cardiovasculares13.
O objectivo deste estudo foi analisar a prevalência da SAHS em doentes com SCA e, adicionalmente, determinar a existência de factores clínicos preditivos de SAHS e comparar a correlação do IAH obtido com um equipamento de estudo de sono simplificado (ESS) com o IAH obtido na polissonografia completa (PSG).
Material e métodosAmostraEstudo prospectivo de 91 doentes consecutivos com SCA, com lesão demonstrada por coronariografia, internados na unidade de cuidados intensivos coronários (UCIC) do nosso hospital, durante o período de Maio a Agosto de 2009. Foram excluídos os doentes: não residentes na área de referência do hospital, com diagnóstico prévio de SAHS, com estado confusional, consumo de sedativos nas últimas 24 horas, instabilidade hemodinâmica, necessidade de oxigenoterapia e os que recusaram participar no estudo.
Foi obtida autorização da Comissão de Ética do Hospital de acordo com a Declaração de Helsínquia e assinado o consentimento informado pelo doente antes da realização do estudo.
Desenho do estudoTodos os doentes realizaram um questionário com as seguintes variáveis: dados demográficos, hábitos toxicofílicos, hábitos de sono, antecedentes patológicos, medicação, sintomas sugestivos de SAHS, escala de sonolência de Epworth (ESE), dados clínicos e cronológicos do evento coronário agudo, exame objectivo e medições antropométricas.
Os doentes que cumpriam os critérios de inclusão realizaram um primeiro ESS com o equipamento ApneaLink™ (ResMed Corporation, Poway, Calif). O ApneaLink™ (AL) tem 2 sensores (cânula de fluxo nasal e oxímetro), fornecendo informação sobre 4 variáveis: fluxo respiratório, ressonar, saturação periférica de oxigénio e frequência cardíaca. O AL utiliza um programa próprio que analisa de forma automática o IAH, entre outros parâmetros e, ainda, permite realizar uma análise manual (versão 8). A leitura do AL foi realizada automática e manualmente, sempre pelo mesmo médico e de forma oculta. Apneia foi definida como a diminuição de 90% do sinal do fluxo durante um mínimo de 10 segundos. A hipopneia foi definida como uma redução do fluxo nasal igual ou superior a 30% do basal, durante pelo menos 10 segundos e acompanhada de dessaturação igual ou superior a 4%. Não foram considerados estudos com menos de 5 horas de registo. Estudos de validação do AL demonstram que este equipamento de estudo de sono tem uma boa sensibilidade e especificidade para IAH ≥ 10/h na PSG, 82,1% e 83,9% respectivamente12,14,15. Assim, o estudo realizado com o AL foi considerado positivo quando IAH ≥ 10/h.
Aos doentes que, após leitura manual do registo do AL, apresentavam um IAH ≥ 10/h foi proposta a realização de PSG e AL em simultâneo. Durante o estudo a cânula nasal foi ligada a um conector em “Y” permitindo o registo em simultâneo do fluxo nasal no AL e PSG. A PSG completa foi realizada no laboratório de sono, com o equipamento Embla® N7000 (Embla Systems, Broomfield, CO, USA) com registo de variáveis fisiológicas: 6 canais de electroencefalograma, electrooculograma, electromiograma (submentoniano e tibiais anteriores), electrocardiograma, termistor e cânula nasal, bandas de esforço torácico e abdominal (pletismografia de inductância), microfone, posição corporal, oximetria, frequência cardíaca e vídeo. A leitura da PSG foi manual, sem o investigador ter conhecimento prévio dos resultados do AL e da informação do doente, conforme as recomendações da American Academy of Sleep Medicine (AASM) (2007)16.
A SAHS foi definida de acordo com os critérios da International Classification of Sleep Disorders (ICSD-2), proposta pela AASM17. Considerou-se SAHS se tinham o IAH, medido com PSG, entre 5-14,9/h e apresentavam pelo menos um dos sintomas como ressonar, fadiga, sonolência diurna e apneias observadas durante o sono, ou os indivíduos com o IAH ≥ 15/h independentemente da presença de qualquer sintoma adicional.
Análise estatísticaTodas as variáveis foram testadas relativamente à sua distribuição normal mediante o histograma de frequências e teste de Kolmogorov-Smirnov. A diferença entre duas médias foi determinada utilizando o teste T-student ou Welch-test. Quando as variáveis apresentavam uma distribuição normal utilizou-se o teste T-student, se pelo contrário esta não fosse normal, usou-se o Welch-test. Proporções e variáveis categóricas foram analisadas com o teste do Qui-quadrado ou de Fisher quando adequado. Considerou-se estatisticamente significativo um valor p<0,05. A análise de correlações foi efectuada utilizando o coeficiente de correlação de Pearson e o coeficiente de correlação intraclasse. A análise de Bland-Altman é uma representação gráfica das diferenças observadas entre as 2 técnicas (PSG e AL) em relação à sua média, de forma que os resultados com reduzida diferença em relação à média indicam pouco enviesamento sistemático. Os dados foram analisados estatisticamente com o software MedCalc® (versão 9.3, Mariakerke, Bélgica).
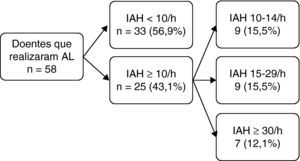
ResultadosDos 91 doentes admitidos inicialmente na UCIC por SCA nos 4 meses do estudo, 24 doentes não residiam na área hospitalar, 7 não aceitaram participar no estudo, 1 faleceu nas primeiras horas do internamento e 1 já tinha diagnóstico de SAHS. Portanto, foram incluídos 58 doentes na análise final. A maioria era do sexo masculino (74%), média etária de 61,7 anos e índice de massa corporal (IMC) médio de 27,4 Kg/m2. As características dos doentes encontram-se representadas na tabela 1. Vinte e oito doentes (48,3%) realizaram o estudo com o AL durante o internamento e os restantes 30 doentes (51,7%) realizaram-no em ambulatório, tendo sido a mediana do tempo desde a SCA até à realização do AL de 4 e 17,5 dias respectivamente. Dos 58 doentes que realizaram o ESS com AL 43,1% obteve um IAH ≥ 10/h, sendo que destes 27,6% tinham um IAH ≥ 15/h e 12,1% um IAH ≥ 30/h (tabela 1 e fig. 1).
Características demográficas, prevalência e comorbilidades dos 58 participantes do estudo.
| Resultados | |
|---|---|
| Características demográficas | |
| Idade (anos) | 61,7 ± 12,2 (22-87) |
| IMC (Kg/m2) | 27,4 ± 3,5 (20,8-37,5) |
| Sexo | |
| Homem | 43 (74,1%) |
| Mulher | 15 (25,9%) |
| Prevalência de IAH | |
| IAH 10-14/h | 9 (15,5%) |
| IAH 15-29/h | 9 (15,5%) |
| IAH ≥ 30/h | 7 (12,1%) |
| Comorbilidades | |
| Dislipidemia | 43 (74,1%) |
| Hipertensão arterial | 42 (72,4%) |
| Diabetes mellitus tipo 2 | 17 (29,3%) |
| Cardiopatia isquémica prévia | 13 (22,4%) |
Dados apresentados em número (%) excepto idade e IMC (Índice de massa corporal), com média±SD (range). Índice de Apneia-Hipopneia (IAH) segundo valores do estudo com ApneaLink.
Os doentes foram comparados em dois grupos segundo o resultado do AL (IAH<10/h versus IAH ≥ 10/h), relativamente às características antropométricas, clínicas e antecedentes. Observaram-se diferenças estatisticamente significativas nas variáveis: existência de obesidade; perímetros de pescoço, abdominal e anca; classificação de Mallampati; história de apneias observadas; história de nictúria; ESE e antecedentes de doença isquémica cardíaca (tabela 2). Ainda, em 48% dos doentes do grupo com IAH ≥ 10/h os sintomas cardíacos tiveram início durante a noite (p=0,009) e na maioria destes doentes a tradução electrocardiográfica da SCA foi sem elevação de ST (p=0,043).
Características clínicas e antropométricas.
| IAH<10/h (n=33) | IAH ≥ 10/h (n=25) | Valor p | |
|---|---|---|---|
| Sexo masculino | 22 (67%) | 21 (84%) | NS |
| Idade (anos) | 60 ± 12 | 64 ± 12 | NS |
| Obesidade (IMC ≥ 30 Kg/m2) | 4 (12%) | 9 (36%) | 0.031* |
| Perímetro do pescoço (cm) | 34 ± 5 | 39 ± 5 | <0,001** |
| Perímetro abdominal (cm) | 93 ± 10 | 99 ± 9 | 0,012** |
| Perímetro das ancas (cm) | 94 ± 10 | 100 ± 8 | 0,034** |
| Mallampati III + IV | 7 (12%) | 21 (36%) | <0,001* |
| Hábitos tabágicos (Fumador) | 11 (33%) | 7 (28%) | NS |
| Hábitos etanólicos (Habitual/Ocasional) | 27 (81%) | 19 (76%) | NS |
| N° cafés por dia | 1,8 ± 1,6 | 1,6 ± 1,4 | NS |
| N° de horas de sono | 6,9 ± 1,7 | 6,8 ± 1,8 | NS |
| Hipertensão arterial | 23 (70%) | 19 (76%) | NS |
| Dislipidémia | 24 (73%) | 19 (76%) | NS |
| Diabetes mellitus | 8 (24%) | 9 (36%) | NS |
| Cardiopatia isquémica prévia | 4 (12%) | 9 (36%) | 0,031* |
| Ressonar | 26 (79%) | 21 (84%) | NS |
| Apneias observadas | 4 (12%) | 12 (48%) | 0,002* |
| Despertares nocturnos | 8 (24%) | 8 (32%) | NS |
| Nictúria (n° de vezes) | 1 ± 0,9 | 2 ± 0,9 | 0,018** |
| Sono agitado | 7 (21%) | 8 (24%) | NS |
| Sono não reparador | 9 (27%) | 9 (36%) | NS |
| Cefaleias | 3 (9%) | 7 (28%) | NS |
| Alteração da memória | 13 (39%) | 13 (52%) | NS |
| Alteração da concentração | 8 (24%) | 9 (36%) | NS |
| Escala de Epworth | 4,5 ± 2,6 | 6,4 ± 4,1 | 0,042*** |
| Escala de Epworth ≥ 10 | 2 (6%) | 5 (20%) | NS |
| Hora de início dos sintomas da SCA | |||
| - 22:01-06:00 | 4 (12%) | 12 (48%) | 0,009* |
| - 06:01-14:00 | 15 (45%) | 6 (24%) | |
| - 14:01-22:00 | 14 (42%) | 7 (20%) | |
| EAM sem supra de ST | 11 (33%) | 15 (69%) | 0,043* |
| N° vasos afectados | 1,7 ± 0,8 | 2,0 ± 0,9 | NS |
| Fracção de ejecção | 58 ± 14 | 59 ± 14 | NS |
| Hipertrofia do septo interventricular | 10 (30%) | 9 (36%) | NS |
Dados são apresentados como n (%) e média ± desvio padrão. IMC: Índice de massa corporal; EAM: Enfarte agudo do miocárdio; N°: Número; NS: Estatisticamente não significativo. * Teste do Qui-quadrado; ** Teste T-Student; ***Welch-test.
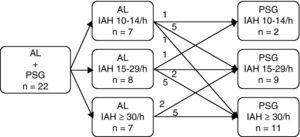
Dos 25 doentes com resultado de IAH ≥ 10/h no AL, 3 doentes recusaram fazer posterior PSG e AL em simultâneo. A mediana da demora desde a SCA até à realização da PSG foi de 30 dias. Dos 22 doentes que realizaram em simultâneo o AL e a PSG, esta confirmou a positividade de todos os casos de SAHS detectados com o AL. Comparando os resultados do IAH do primeiro AL com o IAH obtido na PSG, em 14 doentes (63,6%) foi alterada a classificação da SAHS após a realização da PSG (fig. 2). Em 6 doentes que no primeiro AL foram classificados como ligeiros, após a realização da PSG 5 foram classificados como moderados e 1 como grave; 5 doentes que inicialmente foram classificados como moderados após PSG passaram a ser graves. Apenas 3 doentes foram classificados num estádio de menor gravidade após a realização da PSG, assim 1 doente que no primeiro AL tinha sido avaliado como moderado passou a ligeiro e 2 que eram graves passaram a moderados. Houve 2 doentes que apresentavam um predomínio de apneias centrais na PSG.
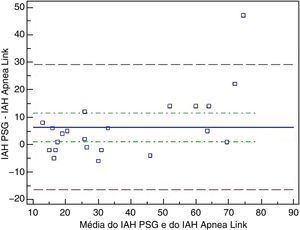
O gráfico Bland-Altman mostrou uma distribuição razoável da diferença entre o IAH da PSG e do AL realizados em simultâneo (fig. 3). Comparando com a PSG, o AL subvalorizou o IAH em média 6,3 eventos hora, isto ocorreu principalmente quando IAH era superior a 30 eventos por hora.
Foi obtida uma correlação muito boa entre o IAH do AL e o IAH da PSG realizados em simultâneo, com um coeficiente de correlação de Pearson de 0,91 (0,79-0,96) e coeficente de correlação intraclasse de 0,93 (0,82-0,97).
Segundo a definição da AASM16, todos os doentes que realizaram a PSG cumpriam os critérios de SAHS. Portanto, os doentes que concordaram, iniciaram tratamento com auto-CPAP (19 doentes) e servoventilação (2 doentes), conforme indicação.
DiscussãoNo nosso estudo foi detectado uma elevada prevalência de SAHS (43,1%) em doentes admitidos com SCA numa UCIC e 27,6% foram classificados como moderados ou graves segundo o AL. A PSG confirmou a positividade de todos os casos detectados com o AL. Os nossos resultados foram consistentes com os obtidos noutros estudos, que descrevem uma associação entre SAHS e doença coronária4,6,7,18,19. Num trabalho desenvolvido noutro Centro Hospitalar em Portugal, estes observaram uma prevalência de SAHS em 65,9% dos doentes com SCA, sendo que 22,7% foram classificados como graves20.
Os doentes internados com SCA na UCIC eram na sua maioria do sexo masculino, com média etária de 61,7 anos e um IMC médio de 27,4 Kg/m2. Estes doentes apresentavam uma prevalência elevada de HTA e dislipidémia.
Cerca de metade dos doentes realizaram o ESS com o AL durante o internamento (no episódio agudo) e os restantes efectuaram-no em ambulatório (no domicílio), numa fase estável da sua doença cardíaca. Desta forma, foi provavelmente, eliminado algum eventual viés, nomeadamente: efeito de alguma medicação que tenha sido administrada no internamento, realização do ESS na fase aguda e poder existir algum grau de disfunção cardíaca e, consequentemente, aparecimento de eventos centrais ou sono de má qualidade derivado do stress da situação clínica ou da actividade incessante própria duma sala de cuidados intensivos.
Comparando os dois grupos de doentes (IAH < 10/h versus IAH ≥ 10/h), o grupo de doentes com SAHS, do ponto de vista antropométrico, apresentava maior número de obesos, valores de perímetros cervical, abdominal e de anca superiores e classificação III-IV de Mallampati, aspectos característicos do doente com “fenotipo típico” de SAHS.
O grupo de doentes com SAHS apresentava nictúria e apneias observadas em maior proporção, sendo estes dois sintomas frequentes nesta doença. De realçar, que mesmo os doentes com apneias observadas não tinham recorrido ao seu médico assistente para realização de um eventual estudo, refletindo a escassa informação da população sobre a importância deste sintoma. Salienta-se que, apesar dos doentes com SAHS apresentarem um valor médio superior na ESE, este era inferior ao valor de referência para sonolência excessiva (ESE ≥ 10), portanto não parece ser este um factor determinante na definição de SAHS nestes doentes. São conhecidas as limitações da ESE quando, por vezes, os doentes subestimam a sua sonolência e, ainda é motivo de controvérsia a existência de doentes com SAHS grave sem sonolência excessiva21.
Assim, os dados que podem sugerir a presença de SAHS são os valores mais elevados nos dados antropométricos, as classes III ou IV da classificação de Mallampati, a história de nictúria e de apneias observadas. Contudo a inexistência destes não nos permite excluir SAHS.
Em relação aos antecedentes, o grupo de doentes com SAHS apresentava significativamente maior número de episódios prévios de cardiopatia isquémica (angina e EAM), situação que poderia indicar uma maior vulnerabilidade dos doentes com lesões coronárias aos episódios de hipoxémia intermitente e activação simpática. Nos doentes com SAHS as apneias e hipopneias estão associadas a dessaturações e microdespertares que conduzem à activação do sistema nervoso simpático, que por sua vez provoca um aumento da frequência cardíaca e da pressão arterial sistólica. A taquicardia e aumento da pressão arterial sistólica aumentam a necessidade de oxigénio pelo miocárdio, que poderá estar comprometida nos doentes com doença arterial coronária4,9,13. Por outro lado, a hipoxémia intermitente crónica através da indução de mediadores inflamatórios, de stress oxidativo e de disfunção endotelial conduz à ateroesclerose8,22.
Nos doentes com SAHS houve um predomínio de início dos sintomas característicos da SCA durante a noite, o que está de acordo com os resultados obtidos noutros estudos9,18,23. Na população em geral, o início da SCA ocorre entre as 6-11 horas, nos doentes com SAHS esta ocorre predominantemente entre as 22-6 horas. Esta observação sugere que a SAHS pode precipitar a SCA nocturna (pelos mecanismos descritos anteriormente) e que a SCA pode contribuir para uma predisposição de morte súbita cardíaca nocturna observada nos doentes com SAHS9,24,25. Contudo, não foi detectada uma relação entre a gravidade da doença coronária (número de vasos afectados) observada na angiografia e a presença de SAHS. Salienta-se que o grupo com SAHS apresentava, na sua maioria, SCA sem elevação de ST, o que pode estar em relação com um aumento da necessidade de oxigénio após o período da apneia (quando a saturação da oxihemoglobina se encontra no valor mais baixo), devido ao aumento da pressão arterial e da frequência cardíaca7,23.
No grupo total de doentes foram detectados, com relativa frequência, eventos respiratórios centrais e episódios breves de respiração de Cheyne-Stokes, sendo significativos em 2 doentes, embora os doentes apresentassem, em média, uma boa fracção de ejecção.
A demora desde a SCA até à realização da PSG foi razoável, dificultando o surgimento de alguns viéses que pudessem modificar os resultados, nomeadamente alterações do estilo de vida que conduzissem à perda de peso ou alterações dos hábitos alcoólicos ou tabágicos.
Comparando os valores de IAH obtidos na PSG e AL simultâneas, estes apresentaram uma muito boa correlação, confirmando a fiabilidade deste equipamento de estudo de sono, já observada noutros estudos12,14,15.
Aos doentes com Síndrome de Apneia Obstrutiva do Sono (SAOS) foi-lhe proposta terapêutica com as medidas higieno-dietéticas consensuais na SAOS e CPAP, uma vez que o tratamento da SAOS em doentes com SCA está associado a uma redução significativa nos eventos cardiovasculares, definidos como morte de causa cardiovascular, SCA, internamentos por insuficiência cardíaca ou necessidade de revascularização coronária. Por outro lado, há um atraso na ocorrência destes eventos9,13,26–28.
Apontamos como possíveis limitações do estudo o tamanho relativamente reduzido da amostra, motivado em parte por exclusão de um elevado número de doentes turistas na região do Algarve que impossibilitava o seu seguimento e conclusão do estudo.
Um ponto “enigmático” é a possibilidade do número de eventos respiratórios, detectados inicialmente, diminuir com o tempo, como sugerido num estudo realizado na Grécia,29 onde os autores concluíram que existia uma elevada prevalência de SAHS na fase aguda da SCA (54%) e que esta decrescia 6 meses após a SCA, mantendo-se o diagnóstico de SAHS apenas em 21% dos doentes, sugerindo que estas alterações podem ser transitórias. Possíveis explicações são a utilização de fármacos (por exemplo analgésicos opióides, e/ou ansiolíticos) enquanto os doentes estão internados na UCIC, que podem afectar o padrão respiratório durante o sono; os doentes quando estão internados na UCIC encontram-se habitualmente na posição supina; a própria patologia cardiovascular aguda pode conduzir a alterações respiratórias durante o sono, com tendência para o aparecimento de apneias centrais.6 São necessários mais estudos para confirmar ou contestar esta hipótese.
ConclusõesEm síntese, e tendo em conta as limitações do estudo, os resultados apontam para uma elevada prevalência de SAHS em doentes com SCA. Dada a elevada prevalência observada, parece justificada a inclusão de um estudo do sono no protocolo de investigação dos doentes internados por SCA. Apesar da PSG ser o teste de diagnóstico gold standard para a SAHS é impossível a sua realização devido aos recursos limitados e à demora média prolongada para a sua execução. Tendo em conta a boa correlação do ESS com equipamentos como o ApneaLink™ em relação com a PSG, assim como a sua fácil utilização e baixo custo, poderia ser útil como primeira linha diagnóstica e em colaboração com a consulta de Sono. Da mesma maneira que, no contexto do SCA, são investigados e tratados outros factores de risco cardiovascular, como por exemplo a HTA, diabetes, tabagismo ou a dislipidemia, o diagnóstico e controlo da SAHS poderia ser importante na prevenção secundária de novos eventos cardiovasculares.
Conflito de interessesOs autores declaram não haver conflito de interesses.
Agradecemos a Linde Homecare e a Resmed o empréstimo dos equipamentos de estudo simplificado de sono para a realização do estudo.