Em 2006, a Unidade de Pneumologia Oncológica do Serviço de Pneumologia do Centro Hospitalar de Vila Nova de Gaia/Espinho iniciou a sequenciação da mutação do recetor do fator de crescimento epidérmico (EGFR) em doentes com CPNPC selecionados e desde 2010 realiza a sequenciação sistematicamente em todos os doentes, independentemente da histologia, hábitos tabágicos, idade ou sexo. O objetivo deste trabalho foi caracterizar o grupo de doentes que efetuou a sequenciação entre 2006-2010, determinar a frequência da mutação EGFR, avaliar as sobrevidas globais e após uso de inibidores da tirosina quinase (ITK), nos doentes que efetuaram esta terapêutica em 2.a e 3.a linha com conhecimento do estado da mutação do EGFR.
MétodosAnálise estatística descritiva dos doentes que efetuaram sequenciação EGFR em 2006-2010 e sobrevida mediana global nos doentes que efetuaefetuaram ITK em 2.a e 3.a linha. Registo do material disponível para análise e demora média de resultado do exame, de acordo com o material enviado.
ResultadosA sequenciação foi efetuada em 374 doentes, 71,1% sexo masculino, 67,1% não/ex-fumadores, 32,9% fumadores; 57,8% adenocarcinoma e 23,5% carcinoma epidermoide (CE). A mutação foi detetada em 49 doentes (13,1%). No total dos doentes estudados, a taxa de mutação foi de 9% no sexo masculino e 23% no sexo feminino. A sobrevida mediana global após o uso de erlotinib foi de 14 meses para os doentes com mutação positiva do EGFR versus 6 meses nos doentes não mutados (p = 0,003).
ConclusãoO nosso grupo teve uma taxa de mutação global de 13,1%, com predomínio no sexo feminino, não fumadores, histologia adenocarcinoma. Em doentes selecionados (2006/2009), a taxa de mutação foi de 16%; nos doentes não selecionados (2010) foi de 10,4%. Este estudo tem vindo a permitir um melhor conhecimento da taxa de mutação do EGFR na população portuguesa, bem como avaliar os resultados das sobrevidas dos doentes após uso de inibidores da tirosina quinase (ITK), efetuada em 2.a e 3.a linha com conhecimento prévio do estado da mutação do EGFR, tendo sido encontradas diferenças nas sobrevidas nos 2 grupos de doentes (mutados e não mutados) com significado estatístico.
A pesquisa mutação do EGFR deve ser efetuada em todos os doentes com CPNPC, dando possibilidade a um número considerável de doentes de poder efetuar um tratamento de 1.a linha com ITK (doentes mutados), bem como de poder usufruir de outros esquemas de quimioterapia, quando progredirem.
In 2006, the Vila Nova de Gaia/Espinho Hospital Centre Pulmonary Oncology Unit started performing EGFR (Epidermal Growth Factor Receptor) mutation sequencing in selected patients with NSCLC and systematically in all patients since 2010, regardless of histology, smoking habits, age or sex. The aim of this study was to characterize the group of patients that carried out the sequencing between 2006-2010, to determine EGFR mutation frequency, to evaluate the overall survival and the survival after the use of tyrosine kinase inhibitors (TKI), in patients who performed this therapy in second and third line, knowing the EGFR mutation status.
MethodsDescriptive statistical analysis of patients who did EGFR sequencing in 2006-2010 and of overall survival in patients treated with TKI as 2nd and 3rd line therapy. Record of the material available for analysis and average delay of exam results, according to the material submitted.
ResultsThe sequencing was performed in 374 patients, 71,1% males, 67,1% non/ex-smokers, 32,9% smokers, 57,8% adenocarcinoma and 23,5% squamous cell carcinoma (SCC). The mutation was detected in 49 patients (13,1%). In all studied patients, the mutation rate was 9% in males and 23% in females. Median overall survival after erlotinib use of was 14 months for patients with positive EGFR mutation versus 6 months in not mutated patients (p = 0.003).
ConclusionOur group had an overall mutation rate of 13.1% with female, non-smokers, adenocarcinoma histology predominance. In selected patients (2006/2009), the mutation rate was 16%, in not selected patients (2010) the mutation rate was 10.4%. This study has permitted a better understanding of the EGFR mutation rate in the Portuguese population as welll as an evaluation of the patients survival after the use of of tyrosine kinase inhibitors, in second and third line therapy with previous knowledge of the EGFR mutational status. Statistical significant differences in survival were found in the two patient groups (EGFR mutated and non mutated).
The EGFR mutation research should be performed in all patients with NSCLC, giving the possibility to a considerable number of patients to perform a first line treatment with TKI (EGFR mutated patients) and the advantage of performing other chemotherapy schemes, when progression occurs.
Os fatores preditivos e de prognóstico no cancro do pulmão de não pequenas células (CPNPC) são importantes quer para o doente quer para o médico, porque podem fornecer um prognóstico mais preciso (em termos de recorrência ou progressão da doença e sobrevivência) e ajudam a estabelecer o melhor tratamento.
Os fatores de prognóstico clássicos incluem história tabágica, estado geral e as comorbilidades do doente. Atualmente, existem marcadores moleculares que se tornaram fatores de prognóstico, sendo atualmente os mais estudados: o recetor do fator de crescimento epidérmico (EGFR) e a mutação do KRAS que, em associação com a histologia, são considerados potenciais fatores preditivos.
Identificar precocemente a subpopulação de doentes que mais provavelmente responderá a uma terapêutica particular aumentando não só a probabilidade de resposta mas evitando também tratamentos desnecessários àqueles doentes que têm poucas hipóteses de beneficiar com o tratamento, é o objetivo principal do tratamento oncológico pulmonar.
Portugal não possui um registo de cancro do pulmão fiável e, por isso, é muito difícil traçar quer o perfil epidemiológico no nosso país, quer a real taxa de incidência do CPNPC, assim como a avaliação clínica no que diz respeito ao seu potencial tratamento.
A Comissão de Pneumologia Oncológica da Sociedade Portuguesa de Pneumologia1 efetuou, no triénio de 2000 e 2002, um estudo em que participaram 22 hospitais portugueses, tendo-se registado 4 396 novos casos de cancro do pulmão; o adenocarcinoma foi o subtipo histológico mais frequente e, em 76,9% dos casos os doentes, encontravam-se em estadio avançado ou metastático de doença.
Embora sendo do nosso conhecimento que, destes indivíduos com doença avançada, apenas 10-12% poderão beneficiar dos inibidores da tirosina quinase (ITK) em 1.a linha, o aparecimento destes fármacos (EGFR-ITK) foi uma mais-valia no tratamento do CPNPC avançado ou metastático quer em 1.a linha, nos doentes com a mutação do EGFR, quer em 2.a e 3.a linha.
Existem vários parâmetros clínicos e moleculares que preveem quais os doentes com CPNPC doença avançada mais suscetíveis de beneficiar do tratamento com inibidores de TK, quer para a terapêutica inicial quer para 2.a linha. Estes indicadores de estudos de fase ii2–5 e iii6 que identificaram parâmetros clínicos associados a melhor resposta clínica, são adenocarcinoma, sexo feminino, não fumadores e etnia asiática7–9.
Mutações ativadoras específicas no domínio TK do EGFR (exão 18-21) estão associadas habitualmente a aumento da resposta aos ITK, erlotinib ou gefitinib, ocorrendo, de acordo com a literatura, na Europa em 10-15% dos doentes com CPNPC e com efeitos laterais facilmente manuseáveis.
O método «gold-standard» para análise da mutação do EGFR é a sequenciação direta do ADN, dos exões 18 ao 21. A percentagem de mutações em cada exão é algo ainda controverso; a grande maioria dos trabalhos, incluindo o grupo espanhol10, só estudaram os exões 19 e 21 (e, neste, só a mutação Leu858Arg). Já foi referido anteriormente que ocorriam mutações nos exões 18 e 20 e que algumas tinham valor preditivo de resposta11. Apontava-se para valores de 5% exão 18; 49% exão 19; 1% exão 20; 45% exão 21. O valor preditivo positivo da mutação Gly719 no exão 18 está bem estabelecido e o valor preditivo negativo das inserções do exão 2012. Penzel et al.13, em 1047 casos analisados, encontraram uma taxa de mutação de 15,6% (exão 18 – 10,4%; exão 19 – 49,7%; exão 20 – 5,5%; exão 21 – 34,4%.).
Não tem sido também consensual a que grupo de doentes deve ser pedida a mutação do EGFR e os estudos efetuados têm excluído habitualmente os doentes com tumores epidermoides e grandes fumadores.
Ainda sem definição clara sobre qual o valor da biópsia (em tumor primário vs. metástases) para o estudo da mutação, no entanto, sempre que possível, o primeiro estudo da mutação do EGFR tem sido efetuado no tumor primário e não nas metástases. Também sem grande tradição entre nós, efetuar nova punção aos doentes que progridem a efetuaefetuar ITK. Em cerca de 50% dos casos de progressão ocorre a mutação Thr790Met (exão 20). Esta mutação confere resistência ao tratamento com ITK, sendo uma mutação secundária que aparece após tratamento e aquisição de resistência e só muito raramente uma mutação primária (alguns autores defendem que pode já estar presente em subclones residuais de células tumorais antes do tratamento com ITK)14.
As melhores respostas ao tratamento com ITK e mutações obtêm-se em doentes com deleções no exão 19 e na mutação Leu858Arg do exão 21, embora tendencialmente com resultados um pouco inferiores à deleção do exão 19; as mutações Gly719 (exão 18) e Leu 861 (exão 21) estão associadas a boa resposta. A evidência é clínica e experimental (in vitro)14.
A Unidade de Pneumologia Oncológica (UPO) do Serviço de Pneumologia do Centro Hospitalar Gaia-Espinho (CHGE) iniciou a pesquisa da mutação do gene do EGFR em 2006 em colaboração com o IPATIMUP (Instituto de Patologia e Imunologia Molecular da Universidade do Porto) em doentes selecionados e já com o uso aprovado em Portugal de erlotinib em 2.a e 3.a linhas. Em 2010, com a aprovação do gefitinib em 1.a linha passou a efetuar esta sequenciação em todos os doentes com CPNPC, independentemente da histologia, estadio, hábitos tabágicos ou sexo, e a tratar com gefitinib em 1.a linha todos os doentes com mutação EGFR positiva15. Pretendia-se, assim, a recolha de dados epidemiológicos de forma prospetiva.
Material e métodosApresentamos os resultados de um registo contínuo, para pesquisa de mutações do EGFR em doentes com CPNPC, realizado no Serviço de Pneumologia do Centro Hospitalar de 2006 a 2010.
Foram avaliados os resultados obtidos após tratamento em 2.a e 3.a linha com ITK em doentes com CPNPC doença avançada que efetuaefetuaram a pesquisa de mutação do EGFR. Os resultados em 1.a linha nos doentes mutados não são alvo de apresentação, dado ainda o pequeno n.° de casos.
No período entre 2006-2009, os critérios de inclusão para o estudo da mutação do EGFR foram histologia adenocarcinoma, não fumadores ou ex-fumadores, independentemente do sexo; no ano de 2010, os critérios de inclusão foram diagnóstico de CPNPC, independentemente do sexo ou do estadio ou hábitos tabágicos. Os doentes foram classificados de acordo com hábitos tabágicos, em fumadores, ex-fumadores (doentes que deixaram de fumar há mais de 12 meses) e não fumadores. Registo do material disponível para análise e demora média de resultado do exame, de acordo com o material enviado.
Nos doentes em estadios avançados que efetuaram erlotinib em 2.a e 3.a linha entre 2006 e 2010, os parâmetros avaliados incluíram idade, sexo, hábitos tabágicos, histologia, estadio TNM na apresentação, regimes prévios de quimioterapia, estado mutacional do EGFR e sobrevida global de acordo com o estado mutacional, sobrevida mediana global após erlotinib.
Todos os cálculos estatísticos foram efetuados com o software SPSS (Statistical Package for the Social Sciences) versão 17.0.
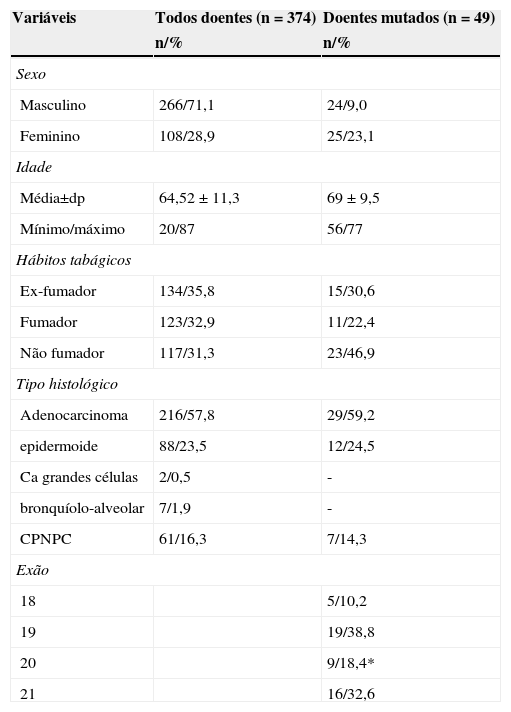
ResultadosNo período entre 1 de janeiro de 2006 a 31 dezembro de 2010, foi efetuada a sequenciação do EGFR em 374 doentes com CPNPC (248 doentes entre 2006-2009 e 126 doentes em 2010). No total de doentes analisados, 266 (71,1%) do sexo masculino e 108 (28,9%) do sexo feminino. Média de idades de 64,5 ± 11,3 anos. Em relação aos hábitos tabágicos, 35,8% ex-fumadores, 31,3% não fumadores e 32,9% fumadores. O tipo histológico predominante – adenocarcinoma (57,8%), seguido do carcinoma epidermoide – 23,5% (tabela 1).
Caracterização da amostra e frequência de mutações EGFR. (* 6,2% foram mutações de resistência)
| Variáveis | Todos doentes (n = 374) | Doentes mutados (n = 49) |
|---|---|---|
| n/% | n/% | |
| Sexo | ||
| Masculino | 266/71,1 | 24/9,0 |
| Feminino | 108/28,9 | 25/23,1 |
| Idade | ||
| Média±dp | 64,52 ± 11,3 | 69 ± 9,5 |
| Mínimo/máximo | 20/87 | 56/77 |
| Hábitos tabágicos | ||
| Ex-fumador | 134/35,8 | 15/30,6 |
| Fumador | 123/32,9 | 11/22,4 |
| Não fumador | 117/31,3 | 23/46,9 |
| Tipo histológico | ||
| Adenocarcinoma | 216/57,8 | 29/59,2 |
| epidermoide | 88/23,5 | 12/24,5 |
| Ca grandes células | 2/0,5 | - |
| bronquíolo-alveolar | 7/1,9 | - |
| CPNPC | 61/16,3 | 7/14,3 |
| Exão | ||
| 18 | 5/10,2 | |
| 19 | 19/38,8 | |
| 20 | 9/18,4* | |
| 21 | 16/32,6 | |
Doentes mutados (n = 49)
10,1% dos doentes encontravam-se no estadio i; no estadio iiem 2,4% dos casos; estadio IIIA em 5,8% e os estadios IIIB/IV em 81,6% dos casos.
As mutações no gene EGFR foram detetadas em 49 de 374 doentes, correspondendo a uma taxa de mutação de 13,1% (a taxa de mutação foi de 9% no sexo masculino e 23% no sexo feminino). No total de doentes mutados, 46,9% eram não fumadores e 59,2% correspondiam a adenocarcinoma (tabela 1).
Quando considerados separadamente, a taxa de mutação nos doentes selecionados entre 2006 e 2009 foi de 16,3 vs. 10,4% no ano de 2010 em que o estudo da mutação começou a ser efetuado a todos os doentes com CPNPC.
A distribuição por exões foi a seguinte: 10,2% no exão 18; 38,8% no exão 19; 18,4% no exão 20 (6,2% foram de resistência); 32,7% no exão 21.
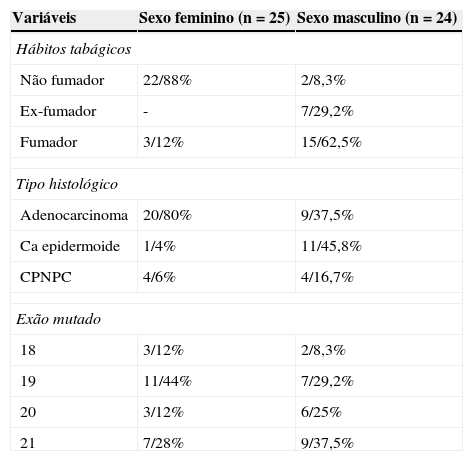
Os doentes do sexo feminino com mutação positiva (n = 25), a maioria não fumadores (22/88,0%) e com predomínio do adenocarcinoma (20/80,0%). Neste subgrupo, 44% das mutações ocorreram no exão 19; 28% no exão 21; 12% no exão 18 e 12% no exão 20 (tabela 2).
Caracterização dos doentes mutados por sexo
| Variáveis | Sexo feminino (n = 25) | Sexo masculino (n = 24) |
|---|---|---|
| Hábitos tabágicos | ||
| Não fumador | 22/88% | 2/8,3% |
| Ex-fumador | - | 7/29,2% |
| Fumador | 3/12% | 15/62,5% |
| Tipo histológico | ||
| Adenocarcinoma | 20/80% | 9/37,5% |
| Ca epidermoide | 1/4% | 11/45,8% |
| CPNPC | 4/6% | 4/16,7% |
| Exão mutado | ||
| 18 | 3/12% | 2/8,3% |
| 19 | 11/44% | 7/29,2% |
| 20 | 3/12% | 6/25% |
| 21 | 7/28% | 9/37,5% |
Nos homens mutados (n = 24), 91,7% eram fumadores ou ex-fumadores e o tipo histológico predominante foi o carcinoma epidermoide em 45,8% dos doentes. As mutações ocorreram em 37,5% no exão 21; 29,2% no exão 19; 25% exão 20 e 8,3% no exão 18 (tabela 2).
Os doentes mutados não fumadores (23), são na sua maioria do sexo feminino (21/91,3%), 78,3% adenocarcinomas, 17,4% CPNPC e 4,3% carcinomas epidermóides. A mutação, na maioria dos não fumadores, ocorreu no exão 19 (43,5%) e exão 21 (34,8%), seguidos do exão 18 (13,0%) e exão 20 (4,3%).
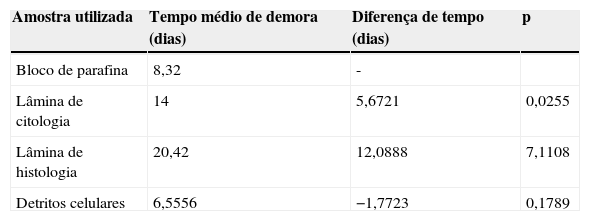
No tempo médio de demora até ao resultado da sequenciação16, verificou-se, de acordo com o tipo de material disponível para estudo que, as lâminas demoram em média 20 dias; o bloco de parafina 8,32 dias e os detritos celulares (com produtos a fresco – EBUS, BAT e outras punções, na presença de anatomia patológica) 6,5 dias (tabela 3).
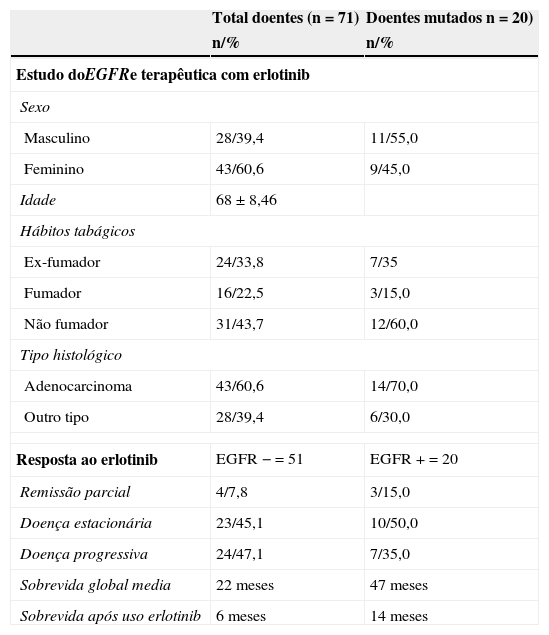
Do total de doentes sequenciados, 71 em estadio avançado ou metastizado efetuaram tratamento de 2.a e 3.a linha com erlotinib 150mg/dia, até à morte, progressão da doença ou toxicidade inaceitável. Neste subgrupo de doentes, verificou-se predomínio do sexo feminino (43/60,6%), não fumadores (31/43,7%) e histologia adenocarcinoma (43/60,6%). A mutação do EGFR positiva em 20 doentes (19,2%), 55% homens e 45% mulheres, na maioria não fumadores (12/60,0%) e histologia adenocarcinoma (14/70%) (tabela 3). Na resposta global ao tratamento com erlotinib, nos doentes com mutação do EGFR negativa (n = 51), verificou-se 47,9% (24) doença progressiva, 45,1% (23) doença estacionária e 7,8% (4) remissão parcial. No subgrupo de doentes tratados com erlotinib com mutação do EGFR positiva (n = 20), 35,0% (7) apresentaram doença progressiva, 50,0% (10) doença estacionária e 15,0% (3) remissão parcial, ou seja, como era de esperar, melhor controlo da doença em doentes com mutação EGFR positiva quando comparado com os doentes com mutação negativa (65,0 vs. 52,9%) (tabela 4).
Características demográficas e resposta ao tratamento dos doentes com estudo do EGFR que efetuaram terapêutica com erlotinib em 2.a linha
| Total doentes (n = 71) | Doentes mutados n = 20) | |
|---|---|---|
| n/% | n/% | |
| Estudo doEGFRe terapêutica com erlotinib | ||
| Sexo | ||
| Masculino | 28/39,4 | 11/55,0 |
| Feminino | 43/60,6 | 9/45,0 |
| Idade | 68 ± 8,46 | |
| Hábitos tabágicos | ||
| Ex-fumador | 24/33,8 | 7/35 |
| Fumador | 16/22,5 | 3/15,0 |
| Não fumador | 31/43,7 | 12/60,0 |
| Tipo histológico | ||
| Adenocarcinoma | 43/60,6 | 14/70,0 |
| Outro tipo | 28/39,4 | 6/30,0 |
| Resposta ao erlotinib | EGFR − = 51 | EGFR + = 20 |
| Remissão parcial | 4/7,8 | 3/15,0 |
| Doença estacionária | 23/45,1 | 10/50,0 |
| Doença progressiva | 24/47,1 | 7/35,0 |
| Sobrevida global media | 22 meses | 47 meses |
| Sobrevida após uso erlotinib | 6 meses | 14 meses |
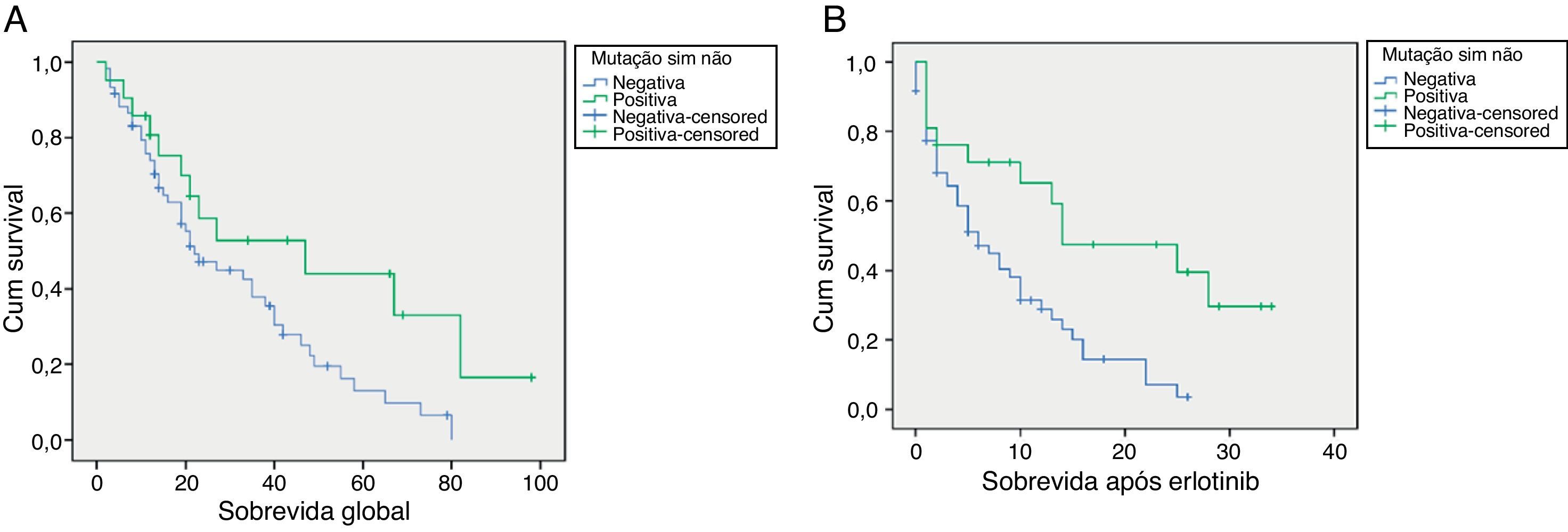
A sobrevida global dos doentes que efetuaram erlotinib com mutação do EGFR positiva vs. doentes não mutados foi de 47 e 22 meses (p = 0,038), respetivamente (fig. 1). A sobrevida média após o tratamento com erlotinib no grupo com mutação EGFR positiva também foi superior neste subgrupo quando comparada com os doentes com mutação negativa (14 vs. 6 meses, respetivamente p = 0,003) (fig. 1).
DiscussãoA nossa amostra revelou uma taxa de mutação do EGFR global (2006-2010) de 13,1%. Uma vez que de 2006 a 2009 houve seleção de doentes, a taxa de mutação foi de 16% vs. 10,4% no ano de 2010 em que o estudo da mutação foi efetuado a todos os doentes com CPNPC independentemente do sexo e estadio. Estes números parecem-nos uma mais-valia para o conhecimento da taxa de mutação do EGFR na população portuguesa; os estudos de prevalência da mutação do EGFR no cancro do pulmão na Europa revelaram, em doentes não selecionados, taxas de mutação de 10%; em Espanha, Rosell et al., obtiveram uma taxa de mutação de 16,6%10, num grupo selecionado de doentes com CPNPC em estadios avançados. A continuação deste nosso trabalho (que nos anos de 2011 e 2012 se tem mantido igualmente numa população não selecionada) vai permitir traçar com segurança o perfil da mutação do EGFR na população portuguesa e poder confirmar estes dados agora apresentados, que mostram a presença da mutação do EGFR na subpopulação de doentes do sexo masculino, carcinomas epidermoides e alguns fumadores. A diferença é, contudo, muito significativa na taxa de mutação em relação aos 2 sexos, sendo o adenocarcinoma responsável pela grande maioria dos casos.
Foi possível efetuar a sequenciação do gene do EGFR em variados tipos de amostras diagnósticas. A sequenciação de DNA a partir de detritos celulares (a fresco ou após cell blok) foi mais rápida comparativamente a lâminas ou bloco de parafina, diferença essa estatisticamente significativa e com impacto no início do tratamento. Isto só foi possível com a colaboração estreita entre os vários elementos envolvidos no diagnóstico do cancro de pulmão (pneumologia oncológica, broncologia, radiologia de intervenção e anatomia patológica). Nos tumores periféricos, ou sempre que seja possível efetuar punções aspirativas, deve-se dar prioridade ao envio deste material a fresco, com obtenção mais rápida dos resultados (6,5 dias após o envio dos produtos).
O estudo da mutação do EGFR deve ser efetuado por rotina em todos os doentes com o diagnóstico de CPNPC e devem ser criadas as condições ao seu uso em todos os hospitais que tratam cancro do pulmão, tendo em conta o seu correto tratamento, pela possibilidade de uso dos ITK em 1.a linha em doentes mutados, com melhor controlo da doença do que com os protocolos de quimioterapia convencional. Todos estes pressupostos assentam na resposta ao tratamento e na sobrevida global no grupo de doentes tratados com ITK16–18.
Os resultados da nossa amostra em 2.a e 3.a linha mostraram significado estatístico no grupo de doentes com mutação positiva para o EGFR, comparativamente aos doentes com mutação negativa, apesar de a presença da mutação do EGFR não ser condição obrigatória para o início de tratamento. Ainda não temos número suficiente de doentes para apresentação dos resultados de 1.a linha dos doentes mutados tratados com ITK.
Conflito de interessesOs autores declaram não haver conflito de interesses.