Está bem documentado que o controlo de asma nem sempre é possível em doentes com asma grave apesar da terapêutica otimizada. O objetivo deste estudo foi avaliar a eficácia de omalizumab no controlo de asma como terapêutica adjuvante em doentes seguidos na consulta de asma grave do Hospital Pulido Valente, em Lisboa.
MétodosRealizámos um estudo retrospetivo que avaliou o controlo de asma quantificado pelo score ACT e pela classificação GINA, a frequência e gravidade das exacerbações, a medicação em curso e a função pulmonar nos doentes tratados com omalizumab. A informação clínica foi obtida através dos registos clínicos da consulta nos doentes submetidos a esta terapêutica, na fase inicial do tratamento e aos 6, 12 e 24 meses de seguimento.
ResultadosVinte e seis doentes iniciaram terapêutica com omalizumab, todos com asma não controlada pela classificação GINA antes do tratamento com uma média de ACT 11,5. Todos os doentes estavam medicados com doses fixas de ICS e LABA e 34,6% também estavam medicados com inalador anticolinérgico. 42,3% dos doentes também estavam medicados com corticoides orais de forma mantida. Os doentes reportavam uma média de 1,8 e 3,1 exacerbações moderadas e graves por ano, respetivamente. Diferenças significativas foram demonstradas no seguimento aos 6 meses na maioria dos parâmetros em estudo com melhoria do score GINA: 60,9% dos doentes passaram a ter asma parcialmente controlada e apenas 39,1% mantiveram asma não controlada (Wilcoxon 0,00); subida do score ACT para 19,52 (Wilcoxon 0,00); melhoria da média de FEV1 para 76,7% (Wilcoxon 0,025); descida na proporção de doentes a necessitar corticoterapia sistémica para 17,4% (Wilcoxon 0,014); e redução do número de exacerbações moderadas e graves para 1,04 e 1,83 por ano, respetivamente.
ConclusõesEste estudo vem demonstrar que o omalizumab é eficaz no controlo da asma como terapêutica adjuvante (GINA degrau 5).
It is widely recognized that asthma control is not always possible in patients with very severe asthma despite available treatment. The aim of this study was to evaluate the efficacy of Omalizumab on asthma control as an add‐on therapy in patients from the «Severe Asthma Outpatient Clinic» of Pulido Valente Hospital in Lisbon, Portugal.
MethodsA retrospective study was conducted to assess asthma control by the ACT score and by GINA classification, frequency and severity of exacerbations, medication use and pulmonary function in patients treated with Omalizumab. Clinical information was collected from medical records from the start of treatment and at 6, 12 and 24 month follow‐up.
Results26 patients started treatment with Omalizumab, all (100%) were classified by GINA with uncontrolled asthma prior to treatment. Mean ACT score was 11.5. All patients had treatment with fixed‐dose ICS and LABA and 34.6% also had an anti‐cholinergic inhaler. 42.3% of patients were also treated with oral glucocorticosteroids for control. Patients reported an average of 1.8 moderate and 3.1 severe exacerbations/year. Statistical differences were found at 6 month follow‐up in most end‐points: GINA score improved: 60.9% of patients with partially controlled asthma and only 39.1% with uncontrolled asthma (Wilcoxon 0.00); ACT score improved to 19.52 (Wilcoxon 0.00); mean FEV1 improved to 76.7% (Wilcoxon 0.025); the proportion of patients requiring oral glucocorticosteroid therapy reduced to 17.4% (Wilcoxon 0.014); and the number of moderate and severe exacerbations also decreased to 1.04 and 1.83 respectively (Wilcoxon 0.007; Wilcoxon 0.002 respectively).
ConclusionsThe current analysis shows evidence that omalizumab is successful in improving asthma control as an add‐on therapy GINA step 5 treatment.
É difícil atingir o controlo na asma grave apesar da terapêutica otimizada. As guidelines da Global Initiative for Asthma (GINA) 2011 recomendam uma abordagem terapêutica com o objetivo de atingir os melhores resultados possíveis em termos de controlo de sintomas, o mínimo uso de medicação de alívio e a melhoria da função pulmonar no intuito de reduzir o risco de exacerbações e a mortalidade devido à asma. A definição de asma grave implica a necessidade de tratamento de elevada intensidade para atingir o controlo sintomático ou para os casos em que não se atinge controlo apesar da terapêutica otimizada1. Estima‐se que aproximadamente 5% dos doentes asmáticos tenham asma grave2. O estudo GOAL demonstrou que uma proporção ainda mais elevada (38‐53%) de doentes estão mal controlados apesar da terapêutica otimizada com a combinação de doses elevadas de corticoides inalados (ICS), beta‐agonistas de longa ação (LABA) e antagonistas de leucotrienos3. Estes doentes manifestam sintomas frequentes com um impacto importante nas suas atividades diárias e sofrem exacerbações com maior necessidade de recorrer aos serviços de saúde1. O omalizumab é o primeiro anticorpo anti‐imunoglobulina E comercializado, tendo já demonstrado eficácia no tratamento da asma alérgica (mediada por IgE). As guidelines da GINA 2011 recomendam o omalizumab como a terapêutica adjuvante indicada para o degrau 5, a acrescentar às combinações de corticoides inalados e LABA. Muitos estudos recentes demonstraram a eficácia de omalizumab para o controlo da asma alérgica grave. No estudo INNOVATE, o omalizumab reduziu a taxa de exacerbações em 26% e diminuiu para metade as exacerbações graves nos doentes com alterações da função pulmonar, já medicados com ICS e LABA e com história de exacerbações significativas no ano prévio. As idas aos serviços de urgência diminuíram 44% relativamente ao placebo. O omalizumab também já demonstrou melhorar significativamente scores de qualidade de vida associados à asma, scores de sintomas de asma e a função pulmonar2,4. O estudo prospetivo EXCELS com 5.000 doentes tratados com omalizumab também já demonstrou uma diminuição na dose de ICS, agonistas beta de curta ação (SABA) e antagonistas dos leucotrienos necessários para controlo sintomático aos 2 anos de seguimento5. Estudos vários reportaram o efeito de poupança dos corticoides sistémicos, o que permite reduzir os vários efeitos adversos desta terapêutica a longo prazo3,6. A segurança e tolerabilidade do omalizumab têm sido consistentes na literatura2,3,7.
O Hospital Pulido Valente tem um dos maiores centros de pneumologia do país para onde são referenciados vários doentes para a consulta de asma grave. Nesta consulta, a pneumologia e a imuno‐alergologia seguem doentes com asma grave e, desde 2006, selecionam doentes elegíveis para terapêutica com omalizumab.
O objetivo desde trabalho foi avaliar a eficácia do omalizumab no controlo da asma desde a sua introdução como terapêutica adjuvante nos doentes selecionados na consulta de asma grave.
MétodosEste foi um estudo observacional em que foram determinados o controlo clínico da asma, a frequência e gravidades das exacerbações, a medicação de manutenção necessária e a função pulmonar em doentes tratados com omalizumab. Os dados foram recolhidos a partir dos registos clínicos datados desde o ano prévio ao início da terapêutica com omalizumab e durante o seguimento aos 6, 12 e 24 meses. O controlo da asma foi quantificado de acordo com os scores da ACT e da graduação das guidelines da GINA. As exacerbações foram classificadas em moderadas ou graves de acordo com as recomendações da ATS para estudos clínicos de asma8. O número anual e a gravidade das exacerbações foram contabilizados. A terapêutica de manutenção também foi registada ao longo do tempo de seguimento. Como este foi um estudo observacional não houve reavaliação com provas de função respiratória em cada um dos intervalos de tempo. A reavaliação funcional era determinada pelo médico assistente. Os resultados do FEV1 foram recolhidos sempre que disponíveis. Os dados foram analisados com o programa SPSS 15. Os dados de seguimento aos 6, 12 e 24 meses foram testados para diferença estatística com as características basais dos doentes.
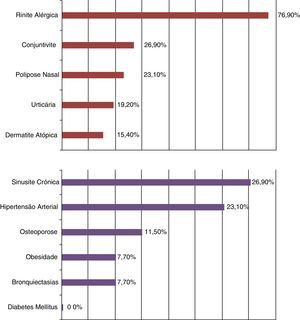
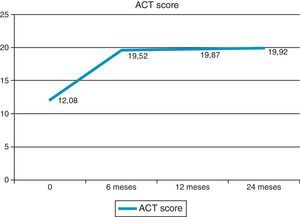
ResultadosVinte e seis doentes iniciaram tratamento com omalizumab (tabela 1). Todos estavam a ser seguidos há pelo menos um ano e sob terapêutica otimizada na consulta de asma grave. A dosagem de omalizumab foi determinada de acordo com o peso e níveis séricos de IgE. Vinte e três doentes atingiram pelos menos 12 meses de seguimento e 13 doentes 24 meses. Um doente abandonou o tratamento com omalizumab aos 12 meses por mudança de residência. Nenhum abandonou o tratamento devido a eventos adversos. As características demográficas e características basais estão retratadas na tabela 1. A maioria eram mulheres caucasianas, não fumadoras. Três doentes eram ex‐fumadores há pelo menos 10 anos (com cargas tabágicas de 15, 15 e 10UMA, respetivamente). Outros dados relevantes da história pessoal estão descriminados na fig. 1. Salienta‐se a elevada incidência de rinite alérgica nesta população (76,9%) e outras doenças atópicas. Todos os doentes com osteoporose mantinham terapêutica de manutenção com corticoides orais antes de iniciar o omalizumab o que demonstra o efeito nocivo desse tratamento. Todos os doentes tinham testes cutâneos positivos a pelo menos um aeroalergeno perene. O nível sérico de IgE variava entre 28,5‐534UI/mL (média de 160,7UI/mL). A média de FEV1 foi 66,7% antes do tratamento. Todos os doentes estavam medicados com doses moderadas a altas de ICS e LABA, e 42,3% estavam medicados com corticosteroides orais em dose de manutenção. Apesar da medicação, todos os doentes reportaram pelo menos uma exacerbação moderada ou grave nos 12 meses prévios ao início do tratamento com omalizumab. A asma foi classificada pela GINA como não controlada em todos os doentes no início do seguimento e a pontuação média de ACT foi de 12,08.
Características demográficas dos doentes
| N | 26 |
|---|---|
| Sexo | |
| Feminino, % | 73,1% |
| Idade, média (SD) | 53 (13,6) |
| Raça | |
| Caucasiano, % | 100% |
| Peso Kg, média (SD) | 81,8 Kg (15,1) |
| História de tabagismo, % | |
| Nunca fumou | 88,5% |
| Ex‐fumador | 11,5% |
| FEV1 (% do previsto) média (SD) | 66,7% (19,1) |
| IgE total (IU/mL) média (SD) | 160,7 (121,1) |
| Duração da asma, anos média (SD) | 28 (13,1) |
| Alergias | 76,9% |
| Ácaros | |
| Fungos | 23,1% |
| Pólens | 73,1% |
| Gramíneas | 46,2% |
| Barata | 11,5% |
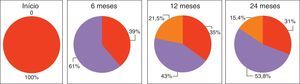
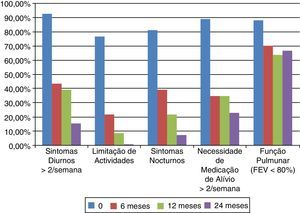
O controlo da asma, classificada a partir da pontuação ACT e classificação GINA, melhorou após o início do omalizumab. A classificação pela GINA melhorou significativamente aos 6 meses de seguimento, com um aumento no número de doentes com asma parcialmente controlada para 60,9%. Após esta melhoria inicial, não houve diferença significativa no controlo da asma aos 12 e 24 meses de seguimento. Quinze por cento dos doentes tinham a sua asma totalmente controlada aos 24 meses de seguimento (fig. 2). A pontuação ACT teve uma progressão semelhante, com um aumento significativo para uma pontuação média de 19,52 aos 6 meses de seguimento. Embora não tenha havido melhoria significativa na pontuação ACT aos 12 e 24 meses de seguimento, os doentes mantiveram um controlo da asma consistente, retratado como uma fase de plateau na fig. 3. Relativamente às características individuais do controlo da asma demostrou‐se que os doentes com sintomas diurnos >2x por semana, a limitação das atividades, sintomas noturnos e necessidade de medicação de alívio >2x por semana, reduziram progressivamente após o início do omalizumab (fig. 4). Diferenças significativas foram encontradas aos 6 meses de seguimento (Wilcoxon <0,01). Também se identificaram diferenças significativas entre os 12‐24 meses de seguimento na percentagem de doentes com sintomas diurnos >2x por semana e necessidade de medicação de alívio (Wilcoxon <0,05) e entre os 6‐24 meses de seguimento na percentagem de doentes com limitação das atividades diárias e sintomas noturnos (Wilcoxon <0,05).
Características do controlo de asma (GINA) no início e aos 6, 12 e 24 meses de seguimento. Sintomas diurnos >2x por semana: 92,3, 43,5, 39,1, 15,4%; limitação das atividades: 76,9, 21,7, 8,7, 0%; sintomas noturnos: 80,1, 39,1, 21,7, 7,7%; uso de medicação de alívio >2x por semana: 88,5, 34,8, 34,8, 23,1%; função pulmonar (FEV1 <80%): 88, 70, 63,6, 66,7%. Diferenças significativas representadas com *.
25 dos doentes tinham registo de provas de função pulmonar iniciais. Aos 6, 12 e 24 meses de seguimento, 9, 11 e 8 doentes repetiram as provas de função pulmonar, respetivamente. O pequeno número de testes de função pulmonar disponíveis dificulta a comparação dos resultados neste ensaio e os resultados devem ser interpretados em conformidade. A percentagem de doentes com FEV1 <90% diminuiu após o início do omalizumab, com diferença estatística aos 12 meses de seguimento (fig. 4). O valor absoluto de FEV1 também aumentou com diferenças significativas aos 6 e 12 meses de seguimento. A comparação dos testes de função pulmonar revelou uma subida de um FEV1 inicial de 57,07 para 76,77% aos 6 meses de seguimento (Wilcoxon 0025). A comparação dos testes de função pulmonar dos valores aos 12 meses revelaram uma subida significativa de 58,61 para 73,9% aos 12 meses de seguimento (p <0,05). Não foram encontradas diferenças significativas aos 24 meses de seguimento, provavelmente devido ao pequeno tamanho da amostra.
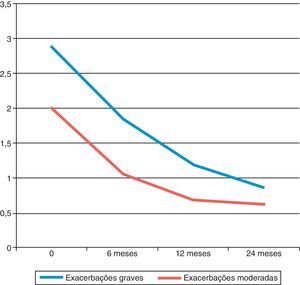
ExacerbaçõesA média do número de exacerbações por ano diminuiu após o início de omalizumab. As exacerbações graves, inicialmente 3,13/ano, reduziram de forma significativa para 1,83 aos 6 meses de seguimento e 1,7/ano em 12 meses de seguimento (Wilcoxon <0,05). A redução dos 12 aos 24 meses de seguimento para 0,84/ano não foi significativa. As exacerbações moderadas também diminuíram significativamente aos 6 e 12 meses de follow‐up desde 1,83/ano para 1,04/ano e 0,7/ano, respetivamente (Wilcoxon <0,05). A redução dos 12 aos 24 meses de seguimento para 0,62/ano não foi significativa (fig. 5).
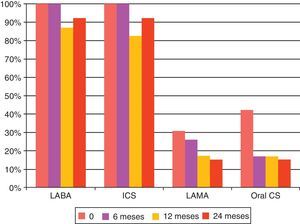
Terapia de manutençãoNo início do estudo 42,3% dos doentes estavam medicados com corticoides orais em terapêutica de manutenção. Houve uma redução significativa para 17,4% na terapêutica de manutenção com corticoides orais aos 6 meses de seguimento (Wilcoxon 0,014) e essa alteração persistiu aos 12 e 24 meses de seguimento. Demonstrou‐se também uma diminuição significativa na terapêutica de manutenção com teofilina de 69,2 para 34,8% aos 12 meses de seguimento (Wilcoxon 0,011). Relativamente à terapêutica de corticoides inalados observámos: a) uma diminuição inicial na percentagem de doentes sob esta terapêutica (82,4% aos 12 meses de seguimento [Wilcoxon 0046]), no entanto, esta tendência não se manteve aos 24 meses de seguimento (fig. 6); b) a dose média inicial de 1.941,35ug/dia de dipropionato de beclometasona ou equivalente reduziu aos 6, 12 e 24 meses de seguimento para 1.576,92ug/dia, 1.600ug/dia e 1.850ug/dia, respetivamente. Só aos 6 meses de seguimento é que se demonstrou diferença estatisticamente significativa (Wilcoxon 0,02), o que poderá refletir a abordagem step‐down da restante medicação de controlo, ou seja, os corticoides orais e teofilina que foram reduzidos.
Eventos adversosForam reportados 2 casos de dor no local da injeção. Num deles somente na primeira administração e no outro nas 2 primeiras administrações. Ambos os eventos resolveram espontaneamente, sem lugar para uma intervenção terapêutica. Não foram relatados outros eventos adversos.
ConclusõesEste estudo reflete a evidência publicada de que o omalizumab é eficaz no controlo da asma como terapêutica adjuvante do passo 5 da GINA. O controlo da asma e a função pulmonar medida pelo FEV1 melhorou, a frequência das exacerbações moderadas e graves diminuíram e a corticoterapia oral também reduziu significativamente com o tratamento com omalizumab. As diferenças mais significativas foram encontradas aos 6 meses de seguimento com melhorias menos significativas aos 12 e 24 meses de seguimento.
Responsabilidades éticasProteção dos seres humanos e animais. Os autores declaram que os procedimentos seguidos estavam de acordo com os regulamentos estabelecidos pelos responsáveis da Comissão de Investigação Clínica e Ética e de acordo com os da Associação Médica Mundial e da Declaração de Helsinki.
Confidencialidade dos dados. Os autores declaram ter seguido os protocolos de seu centro de trabalho acerca da publicação dos dados de pacientes e que todos os pacientes incluídos no estudo receberam informações suficientes e deram o seu consentimento informado por escrito para participar nesse estudo.
Direito à privacidade e consentimento escrito. Os autores declaram ter recebido consentimento escrito dos pacientes e/ou sujeitos mencionados no artigo. O autor para correspondência deve estar na posse deste documento.
Conflito de interessesOs autores declaram não haver conflito de interesses.