Este estudo teve como objectivo determinar os principais sintomas percepcionados pelos doentes com doença pulmonar obstrutiva crónica (DPOC) numa coorte de doentes que participaram num grande ensaio clínico, que avaliou o tiotrópio e que decorreu em Portugal.
População e métodosA caracterização dos sintomas, no momento de avaliação basal dos doentes foi efectuada através do recurso a um questionário padronizado. Os doentes foram inquiridos quanto aos principais sintomas que tinham levado ao diagnóstico e também quanto ao sintoma actual mais problemático.
ResultadosOs resultados foram obtidos de 298 doentes, maioritariamente masculinos (95%), que apresentavam, uma média (desvio padrão) de volume expiratório forçado no primeiro segundo basal de 1,1 (0,4) L (40,6 [13.3] % do valor preditivo), uma duração média da doença de 14,4 (10,1) anos e uma carga tabágica de 55,1 (25,3) unidades maço ano. A dispneia foi o sintoma mais frequentemente reportado, como tendo sido o sintoma que levou ao diagnóstico da doença (55,0% de doentes), seguindo-se-lhe a tosse (33,2%). A dispneia foi também o sintoma actual mais problemático (82,6%), seguindo-se-lhe também a tosse (8,4%). A presença de dispneia ou tosse foi independente da gravidade da DPOC. As comorbilidades mais frequentemente reportadas foram as doenças cardiovasculares (49% dos doentes), gastrointestinais (20%) e metabólicas (16%), principalmente a diabetes mellitus.
ConclusõesEsta análise confirma a importância da dispneia como o sintoma mais comum que leva ao diagnóstico inicial da DPOC e o sintoma actual mais problemático para os doentes. As comorbilidades são comuns entre os doentes com DPOC, pelo que a espirometria deve ser realizada nos doentes que apresentem dispneia associada às patologias mais frequentes.
The aim of this study was to determine patient-perceived characteristics of chronic obstructive pulmonary disease (COPD) in patients participating in a large trial evaluating tiotropium bromide.
Patients and methodsBaseline symptoms were assessed by means of a standardized questionnaire. Patients reported symptoms that led to diagnosis as well as their current most troublesome symptom.
ResultsData were obtained from 298 patients, mostly male (95%), with mean (standard deviation) baseline forced expiratory volume in 1 second of 1.1 (0.4) L (40.6 [13.3] % of predicted), mean disease duration of 14.4 (10.1) years and smoking history of 55.1 (25.3) pack-years. Dyspnoea was the most frequently reported symptom leading to COPD diagnosis (55.0% of patients), followed by cough (33.2%). Dyspnoea was also the current most troublesome symptom (82.6%), followed by cough (8.4%). The presence of dyspnoea or cough was independent of COPD severity. The most commonly reported co-morbidities were cardiovascular disorders (49% of patients), gastrointestinal disorders (20%) and metabolic disorders (16%), mainly diabetes mellitus.
ConclusionsThis analysis confirms the importance of dyspnoea as the most common symptom leading to initial COPD diagnosis and the symptom most troublesome to patients. Co-morbidities are common among COPD patients, and hence spirometric testing is appropriate in a patient who presents with dyspnoea associated with such a condition.
A doença pulmonar obstrutiva crónica (DPOC) tem vindo progressivamente a ser reconhecida como um desafio major de saúde pública1, sendo caracterizada por uma limitação crónica do débito respiratório, geralmente associada aos sintomas de tosse, aumento da produção de expectoração e dispneia2. A caracterização adequada dos sintomas nos vários estádios de gravidade da doença é um passo importante não só para o diagnóstico, mas também para o tratamento.
De acordo com as linhas de orientação da Global Initiative for Chronic Obstructive Lung Disease (GOLD) (Iniciativa Global para a Doença Pulmonar Obstrutiva Crónica)3, o diagnóstico e a gravidade da DPOC são definidos através de parâmetros de função pulmonar. Apesar da caracterização clínica da doença estar bem estabelecida, ainda é necessário um maior conhecimento acerca do curso natural dos sintomas de acordo com os vários estádios de gravidade da doença.
Este estudo teve como objectivo identificar, de acordo com a gravidade da doença, as principais características sintomáticas percepcionadas pelos doentes, que conduziram ao diagnóstico de DPOC, numa coorte de doentes que participaram num ensaio clínico do brometo de tiotrópio. O objectivo desta sub-análise foi identificar, de acordo com a gravidade da doença, não só os sintomas mais frequentes, mas também o/os mais problemático/s.
Doentes e métodosDesenho do estudoForam avaliados trezentos e onze doentes com DPOC, no âmbito de um ensaio clínico que avaliou o brometo de tiotrópio. Este ensaio denominado SPIRIVA Assessment of Forced Expiratory volume in 1 second (SPIRIVA Avaliação do Volume do Débito Respiratório Forçado no primeiro segundo) (SAFE; ensaio # 205.282), tratou-se de um estudo prospectivo, multi-cêntrico, aleatorizado, com dupla ocultação, controlado com placebo e de grupos paralelos, desenhado para determinar se o efeito na função pulmonar de tiotrópio inalado na dose de 18μg, uma vez ao dia, ao longo de 12 semanas, era afectado pelo tabagismo4. Para o efeito, participaram, neste ensaio clínico trinta e um serviços de pneumologia portugueses. O ensaio foi aprovado pelas Comissões de Ética e Conselhos de Administração locais. Todos os doentes prestaram o seu consentimento informado por escrito antes do início de qualquer procedimento relacionado com o ensaio.
O objectivo primário foi a avaliação das alterações no vale do volume expiratório forçado no primeiro segundo (FEV1) após 12 semanas de tratamento4.
Durante a visita inicial de recrutamento, a avaliação dos doentes incluiu a recolha de dados demográficos, história clínica e tabágica, diagnósticos e terapêuticas concomitantes e exame físico, incluindo também testes de estudo da função pulmonar.
Os grupos do ensaio foram formados por doentes externos dos dois sexos com idades ≥40 anos e diagnóstico clínico de DPOC, conforme definido pela American Thoracic Society (ATS)5. Como critérios de inclusão os doentes tinham que apresentar uma carga tabágica de pelo menos 10 Unidades Maço Ano, obstrução das vias respiratórias clinicamente estável e DPOC moderada a muito grave, definida por um valor de FEV1 pré broncodilatação ≤70% do valor previsto com um valor de FEV1/capacidade vital forçada (FVC) ≤70%. Esta definição de gravidade da DPOC estava em conformidade com as guidelines GOLD à data em que o ensaio foi desenhado (2002)3, onde se preconizava a utilização do valor de FEV1 pré broncodilatação e não o seu valor pós broncodilatação. Os doentes eram excluídos se fossem considerados como estando em risco de DPOC (ou seja com função pulmonar normal associada a tosse e expectoração), novamente segundo as recomendações GOLD datadas de 20023. Outros critérios de exclusão foram: história de asma, rinite alérgica, atopia, história recente (6 meses ou menos) de enfarte do miocárdio, arritmia instável e qualquer patologia clinicamente significativa que pudesse colocar o doente em risco devido à sua participação no ensaio. Os doentes com ≥3 exacerbações de DPOC no ano anterior ou uma exacerbação/infecção das vias respiratórias inferiores nas 6 semanas anteriores à aleatorização foram também excluídos.
Nenhum dos doentes tinha sido tratado anteriormente com tiotrópio.
Avaliação dos sintomasNesta análise, foi avaliado o primeiro sintoma que levou ao diagnóstico de DPOC e o sintoma mais problemático para o doente, no momento do recrutamento.
O primeiro sintoma que levou ao diagnóstico da DPOC foi investigado através da análise dos processos clínicos dos doentes onde se encontrava a história clínica de cada doente.
O sintoma mais problemático mais frequente, incluindo pieira, falta de ar (dispneia), tosse e sensação de opressão torácica, foi avaliado através da aplicação de um questionário padronizado no momento da aleatorização (vide Apêndice para detalhes adicionais). Cada investigador preencheu este questionário, proporcionando assim uma avaliação do sintoma mais problemático para o doente, com base no seu estado de saúde na semana anterior à prestação da informação. Nesta avaliação, a gravidade de cada sintoma foi classificada como ligeira (sintoma percepcionado mas facilmente tolerado), moderada (sintoma causando desconforto suficiente para interferir com a actividade quotidiana) ou grave (sintoma provocando incapacidade para trabalhar ou realizar as tarefas diárias). A avaliação dos sintomas foi realizada antes da realização da espirometria.
Análise espirométricaAs avaliações espirométricas basais foram efectuadas entre as 07:00h e as 10:00h, duas semanas antes da aleatorização. As manobras espirométricas foram realizadas em triplicado, tendo sido registados os valores de FEV1 e FVC mais elevados. Estas avaliações foram realizadas num espirómetro Datospir 120C (Sibelmed, Barcelona, Espanha) de acordo com os critérios da ATS6. Os valores previstos da normalidade para o FEV1 e a FVC decorreram da aplicação de equações de referência europeias7.
Análise estatísticaA análise dos dados foi baseada na coorte de doentes incluídos na análise primária dos doentes. O sistema Oracle Clinical foi utilizado para gerir a base de dados e a análise estatística foi realizada utilizando o software SAS (Instituto SAS, versão 8.2). Foi realizada uma análise descritiva dos doentes de acordo com o questionário utilizado.
Os resultados são apresentados como média e desvio padrão (DP). As comparações estatísticas foram efectuadas com o recurso ao teste t Student para dados paramétricos, testes Mann Whitney U para dados não-paramétricos e teste χ2 para dados descritivos. Foi considerado significativo um p<0, 05.
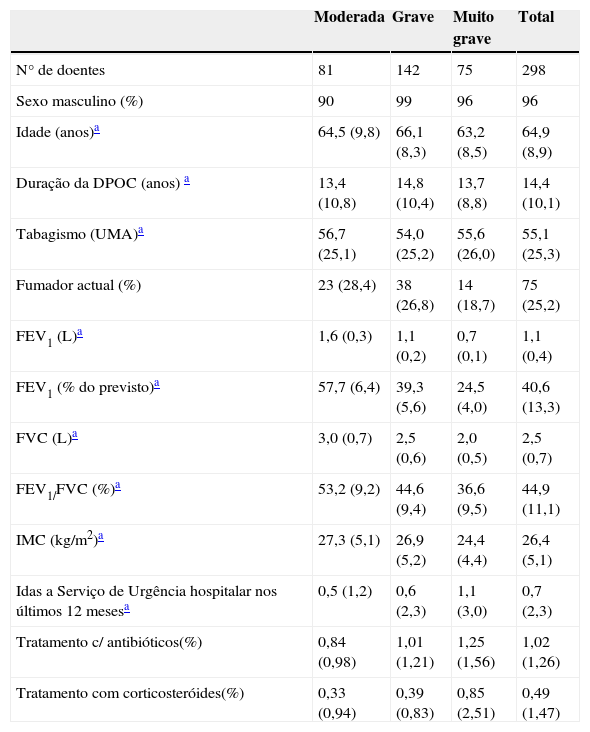
ResultadosForam aleatorizados para tratamento, um total de 311 doentes de 31 centros. Destes, 13 doentes foram excluídos da análise, após a aleatorização devido aos seguintes motivos: 7 alteraram o hábito tabágico durante o ensaio e 6 não preenchiam os critérios de inclusão quando foram reavaliados na visita basal. Assim, foram incluídos na análise 298 doentes cujas características se encontram discriminadas no Tabela 1, de acordo com a gravidade basal. Os doentes eram maioritariamente do sexo masculino e apresentavam DPOC moderada a muito grave, conforme definido pelos estádios GOLD, mas utilizando os valores de FEV1 pré broncodilatação.
Dados demográficos de avaliação basal, em função da gravidade da doença.
| Moderada | Grave | Muito grave | Total | |
|---|---|---|---|---|
| N° de doentes | 81 | 142 | 75 | 298 |
| Sexo masculino (%) | 90 | 99 | 96 | 96 |
| Idade (anos)a | 64,5 (9,8) | 66,1 (8,3) | 63,2 (8,5) | 64,9 (8,9) |
| Duração da DPOC (anos) a | 13,4 (10,8) | 14,8 (10,4) | 13,7 (8,8) | 14,4 (10,1) |
| Tabagismo (UMA)a | 56,7 (25,1) | 54,0 (25,2) | 55,6 (26,0) | 55,1 (25,3) |
| Fumador actual (%) | 23 (28,4) | 38 (26,8) | 14 (18,7) | 75 (25,2) |
| FEV1 (L)a | 1,6 (0,3) | 1,1 (0,2) | 0,7 (0,1) | 1,1 (0,4) |
| FEV1 (% do previsto)a | 57,7 (6,4) | 39,3 (5,6) | 24,5 (4,0) | 40,6 (13,3) |
| FVC (L)a | 3,0 (0,7) | 2,5 (0,6) | 2,0 (0,5) | 2,5 (0,7) |
| FEV1/FVC (%)a | 53,2 (9,2) | 44,6 (9,4) | 36,6 (9,5) | 44,9 (11,1) |
| IMC (kg/m2)a | 27,3 (5,1) | 26,9 (5,2) | 24,4 (4,4) | 26,4 (5,1) |
| Idas a Serviço de Urgência hospitalar nos últimos 12 mesesa | 0,5 (1,2) | 0,6 (2,3) | 1,1 (3,0) | 0,7 (2,3) |
| Tratamento c/ antibióticos(%) | 0,84 (0,98) | 1,01 (1,21) | 1,25 (1,56) | 1,02 (1,26) |
| Tratamento com corticosteróides(%) | 0,33 (0,94) | 0,39 (0,83) | 0,85 (2,51) | 0,49 (1,47) |
Abreviaturas: DPOC: doença pulmonar obstrutiva crónica; UMA: unidades maço ano; FEV1: volume expiratório forçado no primeiro segundo; FVC: capacidade vital forçada; IMC: índice de massa corporal.
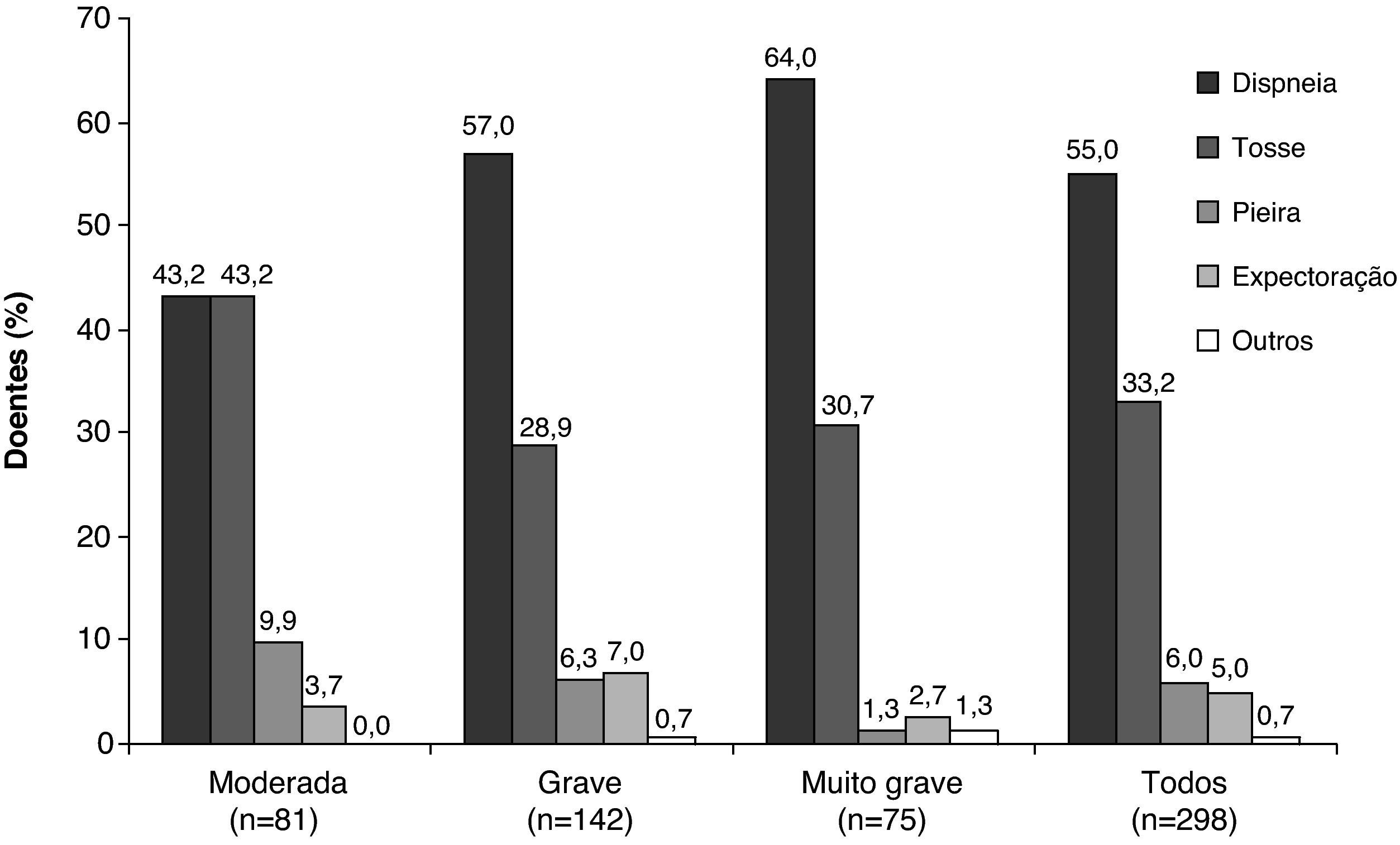
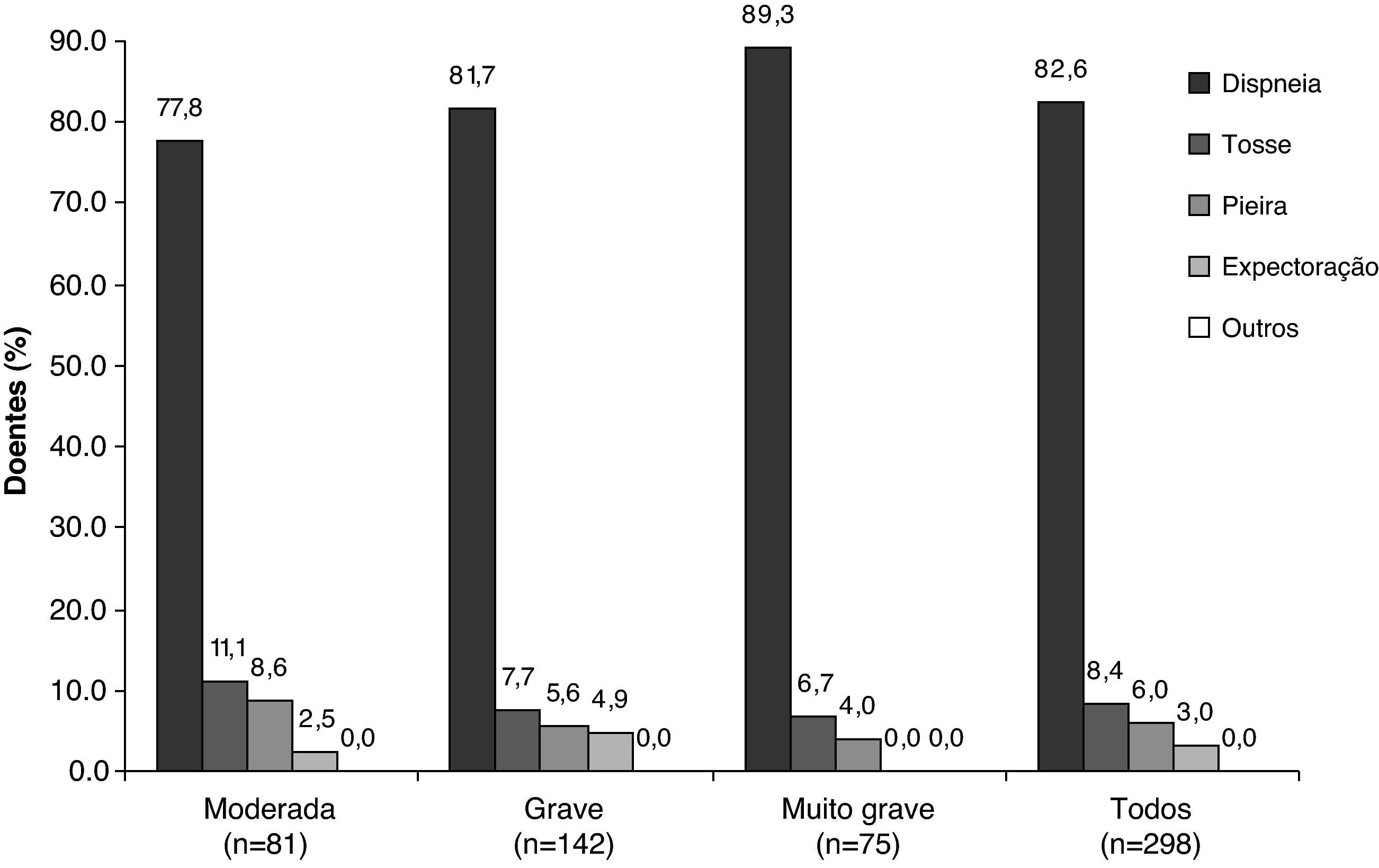
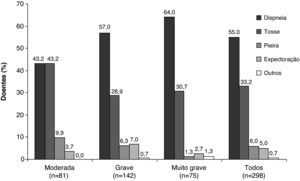
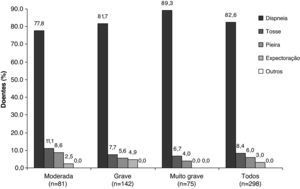
A dispneia foi o sintoma que levou ao diagnóstico de DPOC, reportado com maior frequência, ocorrendo em 55% dos doentes. Foi também o sintoma mais frequente que levou ao diagnóstico em todos os estádios da doença, excepto no estádio moderado, onde a dispneia e a tosse apresentaram uma prevalência equivalente (Figura 1). Foi também o sintoma mais problemático referido com maior frequência pelos doentes, independentemente da gravidade da doença, sendo referido por 82,6% dos doentes (Figura 2). A tosse foi o segundo sintoma mais referido que levou ao diagnóstico (em 33,2% dos doentes) (Figura 1), sendo também o segundo sintoma mais problemático (8,4%) (Figura 2). No grupo de gravidade moderada, a frequência da tosse e da dispneia foram semelhantes no momento do diagnóstico, tal como já referimos (Figura 1). No entanto, quando comparada com a dispneia, a tosse apresentou um padrão de frequência inverso (Figura 2), se considerarmos a gravidade da doença. De assinalar que apenas 5% dos doentes relataram expectoração como o primeiro sintoma que levou ao diagnóstico (Figura 1).
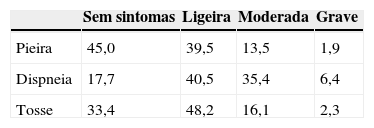
Relativamente à gravidade dos sintomas, no momento da avaliação basal, a dispneia foi ligeira ou moderada em 75,9% dos doentes, a tosse foi ligeira ou moderada em 64,3% dos doentes e a pieira relatada em 53% dos doentes (Tabela 2). Não foi observada uma associação estatisticamente significativa entre a história tabágica (fumadores actuais versus ex-fumadores) e o primeiro sintoma que levou ao diagnóstico (p=0,699) ou com o sintoma mais problemático (p=0,554).
Do mesmo modo, não se observou uma associação estatisticamente significativa entre o índice de massa corporal (IMC) e o primeiro sintoma que conduziu ao diagnóstico (p=0,80) ou com o sintoma mais problemático (p=0,336).
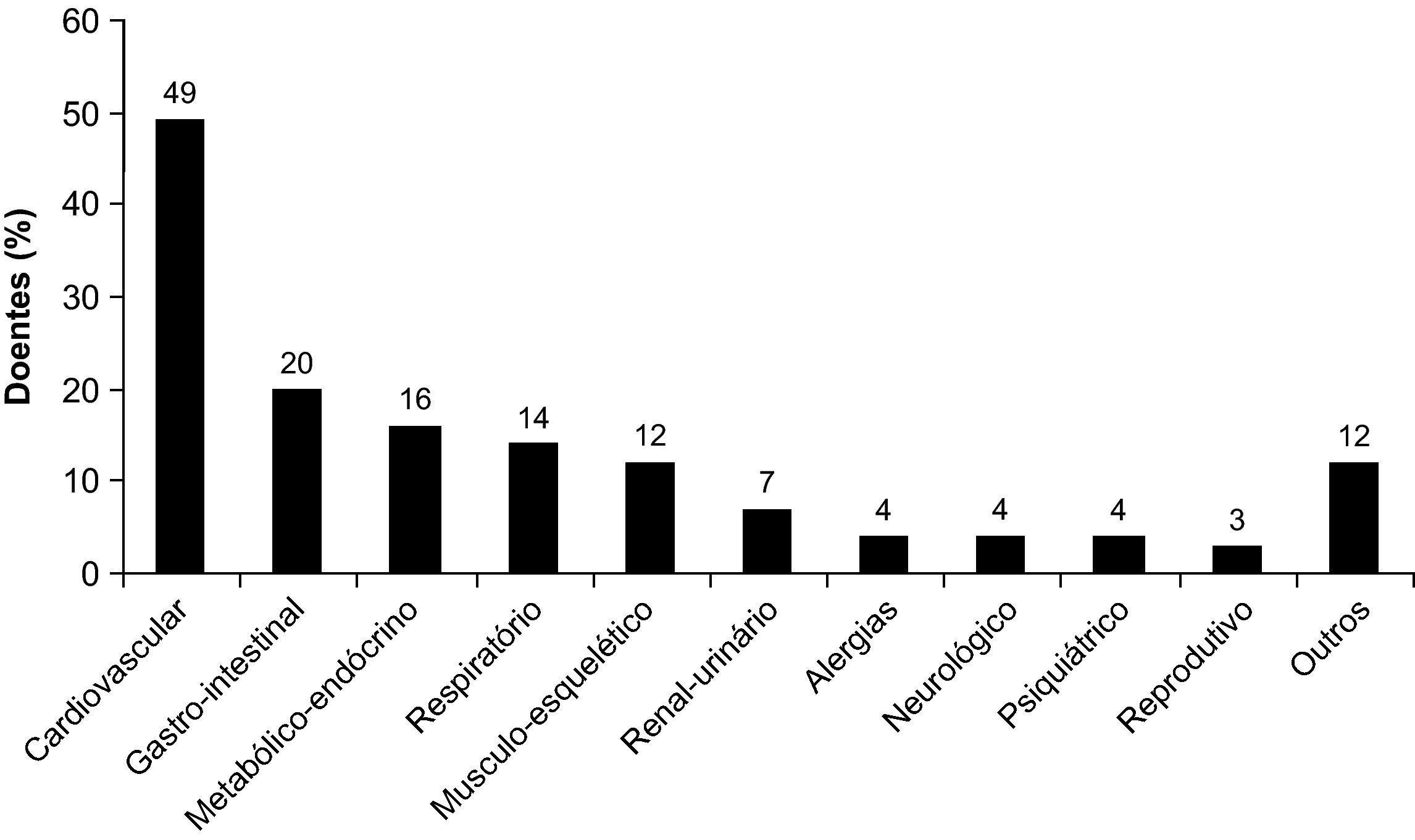
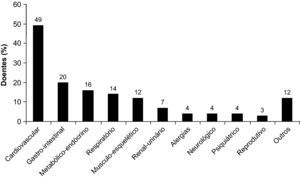
Cerca de metade (49%) dos doentes incluídos no estudo apresentavam patologia cardiovascular nos últimos 5 anos, sendo este o diagnóstico concomitante mais frequente (comorbilidade), seguido por doença gastrointestinal (20%) e patologias metabólicas e/ou endócrinas (16%) (Figura 3). Entre o grupo de doentes que apresentavam comorbilidades cardiovasculares, a hipertensão arterial foi a mais frequente, estando presente em 88% do grupo global de doentes. No grupo com doença gastrointestinal, 85% tinham doença péptica; e no grupo das perturbações metabólicas 53% tinham diabetes mellitus. Em 14% (n=48) dos doentes foram reportadas patologias respiratórias. Destes, 14 tinham o diagnóstico de síndrome de apneia obstrutiva do sono ou sequelas de tuberculose (n=8), os restantes 26 apresentavam um diagnóstico que poderia ser considerado como uma complicação da DPOC: pneumonia (n=13), exacerbações de DPOC (n=4), pneumotórax (n=4), bronquiectasias (n=3), tromboembolismo pulmonar (n=1) e cancro do pulmão (n=1).
No ano anterior ao ensaio, a utilização de recursos de saúde foi em média superior a uma episódio/ano de recurso ao serviço de urgência, apenas no grupo de doentes muito graves, face aos grupos moderado e grave onde estes episódios apresentaram uma menor prevalência (Tabela 1). Do mesmo modo, o grupo muito grave tendencialmente recebeu um maior número de prescrições de antibióticos ou de corticosteróides orais durante o ano anterior, face aos outros 2 grupos.
DiscussãoA análise da população estudada demonstrou que a dispneia é o sintoma mais frequente que conduz ao diagnóstico de DPOC em todos os estádios da doença, sendo igualmente o sintoma mais problemático em todos os níveis de gravidade. Estes resultados são consistentes com o conhecimento prévio de que a dispneia é o primeiro sintoma que leva um doente a procurar cuidados médicos8. Por outro lado, embora a tosse seja habitualmente o primeiro sintoma a ocorrer, usualmente é negligenciada pelos doentes8. As queixas de dispneia aumentam com o aumento da gravidade da doença. Estes resultados sugerem que a dispneia deve ser considerada como um marcador de diagnóstico da DPOC, mesmo em estádios menos graves ou moderados. Uma vez que a dispneia foi o sintoma mais problemático para os doentes com DPOC, deverá igualmente constituir um objectivo primário de tratamento.
Deve realçar-se que a tosse, o sintoma principal que levou ao diagnóstico em doentes com DPOC moderada, se revelou um sintoma relativamente menos problemático com o aumento da gravidade da doença, ao contrário da dispneia, que aumentou em todos os grupos de doença grave.
Resultados idênticos aos nossos têm sido relatados na literatura. Assim, uma sondagem realizada telefonicamente em doentes com DPOC residentes na América do Norte e na Europa referiu elevada prevalência de sensação de falta de ar nas actividades diárias9. De acordo com esta sondagem, um quinto dos doentes referiu ficar com sensação de falta de ar, mesmo quando sentados ou deitados em repouso, e 24% até mesmo quando falavam. Um terço afirmou que ficava com falta de ar quando realizava tarefas ligeiras em casa ou quando se lavava ou vestia e quase 70% ficava com falta de ar quando subia um lance de escadas. Torna-se evidente, com base nestes dados, que a DPOC tem um grande impacto como doença e que afecta muitas actividades que são fundamentais para a vida diária, como a capacidade de respirar, falar, trabalhar, dormir, ter actividade sexual e socializar. No entanto, no mesmo estudo9, os doentes com DPOC consideravam a sua doença como ligeira a moderada, apesar de sofrerem de dispneia relativamente grave. Este último dado realça as dificuldades inerentes ao diagnóstico da DPOC com base nos sintomas. Esta patologia é muitas vezes sub-diagnosticada, pelo menos parcialmente devido ao facto dos próprios doentes não reconhecerem os sintomas relevantes10. O diagnóstico de DPOC deve ser ponderado em qualquer doente que apresente tosse, dispneia ou produção de expectoração, particularmente se o doente esteve exposto a factores de risco8,11. O factor de risco mais bem estabelecido para a DPOC é a exposição ao fumo de tabaco8. Estudos epidemiológicos demonstraram que, com exposição suficiente, a maior parte dos fumadores irá eventualmente desenvolver limitações a nível respiratório12. Deste modo, um dos critérios de inclusão no presente estudo foi uma história de tabagismo positiva. Outros factores de risco incluem a poluição do ar dentro de casa, a exposição ocupacional a poeiras, gases ou fumos e influências genéticas8.
Os doentes que participaram neste ensaio clínico apresentavam DPOC moderada a muito grave, e estavam a ser tratados em centros da especialidade. Assim coloca-se a questão da incapacidade de generalização das conclusões à população geral. De facto, porque estes doentes foram seleccionados em serviços de pneumologia, correspondem a um sub-grupo de doentes com DPOC e não são completamente representativos da população com DPOC na vida real. A elevada prevalência de doentes do sexo masculino (96%) pode ter sido resultado desta selecção. Akamatsu et al demonstraram que os sintomas isolados apresentavam uma baixa sensibilidade para o diagnóstico da DPOC e recomendaram a confirmação do diagnóstico através de espirometria13. Outros estudos no entanto, demonstraram que, questionários baseados em sintomas característicos de DPOC são adequados para a população geral. Num outro estudo, um questionário com base na idade, sintomas (pieira e produção de expectoração), história de tabagismo, IMC e diagnóstico anterior de doença pulmonar obstrutiva apresentou uma sensibilidade de 85% e uma especificidade de 45%10. Este resultado foi comparável ao obtido com outros instrumentos desenhados para utilização na população geral14. No nosso estudo, a dispneia foi o principal sintoma que conduziu ao diagnóstico de DPOC. Ao contrário, num estudo realizado a nível dos cuidados de saúde primários na Holanda, a tosse crónica registou o melhor valor preditivo para DPOC entre os fumadores15. No entanto, deve notar-se que neste estudo numa população de 169 fumadores apenas 30 apresentavam obstrução das vias aéreas; além disso, os critérios de obstrução foram um FEV1<80% dos valores previsíveis, permitindo a inclusão de doentes com uma patologia menos grave do que os incluídos no nosso ensaio (FEV1 ≤70% dos valores previstos).
Apesar da dispneia e da tosse serem bons factores preditores de DPOC, as guidelines actuais recomendam, em todos os doentes em que haja suspeita clínica de DPOC, o recurso à espirometria a fim de confirmar o diagnóstico. Por este motivo, encoraja-se a utilização da avaliação espirométrica a nível dos cuidados primários3,11.
Inesperada foi a observação de que apenas 5% dos doentes reportaram expectoração como primeiro sintoma que conduziu ao diagnóstico de DPOC. Uma possível explicação para este resultado poderá estar relacionada com dificuldade de evocação de sintomas, face à elevada duração média da doença (14,4 anos), na altura da aplicação do questionário.
Outra limitação do nosso estudo prende-se com o elevado número de comorbilidades associadas com a DPOC. É possível que, em alguns casos, estas comorbilidades possam ter introduzido algum factor de confusão na avaliação dos sintomas decorrentes da DPOC, uma vez que essas mesmas patologias podem por si próprias ser indutoras de sintomas idênticos aos da DPOC. Particularmente as perturbações respiratórias, que foram relatadas em 14% dos doentes, na maioria dos casos poderiam ter conduzido a sintomas relacionados com complicações da DPOC. No entanto, estas situações requerem algum cuidado na análise. Assim, por exemplo, embora a pneumonia seja uma característica comum das exacerbações de DPOC, existem diferenças importantes entre as exacerbações com e sem pneumonia. É o caso dos doentes com pneumonia que tendem a apresentar um início mais rápido de sintomas e uma maior gravidade clínica, face aos que não têm pneumonia16,17. Embora a dispneia possa ser sintoma, quer de doença cardíaca congestiva, quer de DPOC, parece pouco provável que este tenha sido um factor de confusão importante neste estudo, uma vez que apenas 19 doentes (6,4%) apresentavam o diagnóstico de insuficiência cardíaca.
Actualmente existe uma forte evidência científica de que as morbilidades concomitantes são comuns nos doentes com DPOC, embora a prevalência reportada seja muito variável17–26. Existe, por exemplo, um crescente corpo de evidência epidemiológica que liga a DPOC à doença cardiovascular21,22. Extensos estudos com base populacional sugerem que os doentes com DPOC apresentam um risco 2 a 3 vezes superior de mortalidade cardiovascular face aos grupos controlo21–24.
O perfil de comorbilidades observado no nosso ensaio foi consistente com o relatado noutros estudos17,18,26. Considerando que alguns critérios de exclusão foram relacionados com a presença de algumas comorbilidades, a frequência real de comorbilidades poderá estar subestimada. Em concordância com os nossos resultados, Antonelli Incalzi et al25 num estudo em 270 doentes com DPOC, que tinham tido alta hospitalar após uma exacerbação aguda de DPOC, constataram que as comorbilidades mais frequentes foram a hipertensão arterial (28%), a diabetes mellitus (14%) e a cardiopatia isquémica (10%). Numa revisão da literatura, Chatila et al17 demonstraram que as doenças cardiovasculares estavam presentes em 13-65% dos doentes com DPOC, a hipertensão em 18-52%, a diabetes mellitus em 5–16% e as perturbações gastrointestinais em 15-62%. Mais recentemente, Agusti et al26, no estudo Eclipse, apresentaram uma prevalência de comorbilidades na DPOC superior à do grupo controlo e com frequências semelhantes às do nosso estudo.
Face a esta realidade, podemos afirmar que o aumento da prevalência de comorbilidades na DPOC pode proporcionar uma oportunidade para identificar com eficiência doentes com DPOC não diagnosticada, sempre que estejamos perante a comorbilidade e sintomas sugestivos de DPOC.
Os resultados do presente estudo reforçam a importância da associação entre a dispneia e as principais comorbilidades da DPOC, quando se pondera um diagnóstico de DPOC. Assim, os autores sugerem que a nível de cuidados de saúde primários, um doente que apresente dispneia associada a doença cardiovascular, ou doença péptica e/ou diabetes mellitus deve ser submetido a uma avaliação espirométrica, de forma a excluir o diagnóstico de DPOC.
Conflito de interesseOs autores declaram não haver conflito de interesse.
DeclaraçãoO estudo SAFE foi suportado pela Boehringer Ingelheim (Lisboa, Portugal) e pela Pfizer (Lisboa, Portugal).
Os autores agradecem a contribuição dos seguintes investigadores do estudo SAFE: Dra. Maria de La Salete Valente, Dr. Ricardo Nascimento, Dr. Carlos Boavida, Dr. Ulisses Brito, Dr. Conceição Antunes, Dr. João Roque Dias, Dr. Dias Pereira, Dra. Teresa Cardoso, Dr. Reis Ferreira, Dr. Jorge Roldão Viera, Dr. Abílio Reis, Dra. Aida Coelho, Dr. Sousa Barros, Dr. Carlos Alves, Prof. Dr. Amaral Marques, Dra. Paula Simão, Dr. José Vieira, Prof. Dr. Bugalho de Almeida, Dra. Olga Freitas, Dra. Paula Duarte, Dr. João de Almeida, Dr. Mariano Machado, Dr. Luís Goes, Dr. Simões Torres, Dra. Maria Manuel Machado, Dr. Júlio Gomes e Dr. Luís Oliveira.
Os autores gostariam também de agradecer ao Dr. José Antunes, Dra. Marisa Sousa, Dra. Ana Cristina Bastos, Dra. Maria Luísa Santos, Esmeralda Violas e Conceição Peralta pelo seu trabalho apoiando este estudo. Reconhecemos o apoio editorial realizado pela Natalie Barker, da PAREXEL MMS Europe Ltd, cujo trabalho foi suportado pela Boehringer Ingelheim e Laboratórios Pfizer.
A Prof. Doutora Cristina Bárbara, o Dr. Joaquim Moita, o Dr. João Cardoso e o Dr. Rui Costa foram os investigadores que mais doentes recrutaram para este estudo. A Dra. Raquel Redondeiro e a Dra. Márcia Gaspar são colaboradoras da Boehringer Ingelheim. Este estudo foi suportado financeiramente pela Boehringer Ingelheim e Laboratórios Pfizer.