A drenagem linfática profunda desempenha um papel importante no pulmão, uma vez que remove materiais estranhos depositados sobre a superfície das vias respiratórias, tais como microrganismos patogénicos. Esta drenagem está igualmente associada às vias de disseminação tumoral. Liposomas com uma membrana especificamente desenhada foram usados para simular partículas estranhas a ser removidas pelos linfáticos pulmonares. Pretendem obter-se imagens dos linfáticos profundos em babuínos usando liposomas que encapsulam 99mTc-HMPAO sob a forma de aerossol. Observaram-se gânglios linfáticos axilares 30min pós-inalação, que se tornaram mais evidentes 1 hora após, quando os gânglios abdominais e aórticos também se tornaram visíveis. Imagens tardias não acrescentaram informação relevante. Foram desenhadas ROI's (regiões de interesse), bem como as correspondentes curvas de actividade-tempo para obter informação acerca da biocinética. Em conclusão, pode dizer-se que a técnica proposta torna possível a visualização da rede linfática profunda do pulmão e os gânglios linfáticos. Esta metodologia poderá vir a ser importante na libertação pulmonar controlada de fármacos citotóxicos.
Deep lymphatic drainage plays an important role in the lung, as it removes foreign materials laying on the airways surface, such as pathogenic microorganisms. This drainage is also associated with lung tumour dissemination route. Liposomes with a specially tailored membrane were used as foreign particles to be removed by the lung lymphatics. We aim to obtain images of deep lung lymphatics in baboons using liposomes encapsulating 99mTc-HMPAO, as aerosols. Axillary lymph nodes were visualized 30min post-inhalation, becoming more evident 1 hour after, when abdominal aortic and inguinal lymph nodes were also observed. Late images added no additional information. ROI's and their time-activity curves were drawn to obtain biokinetic information. In conclusion, we can say that the proposed technique enables visualization of the deep lymphatic lung network and lymph nodes. This methodology may be an important tool for targeted lung delivery of cytotoxic drugs.
A densa rede linfática profunda existente no tecido conjuntivo da pleura visceral, tanto dos folhetos peribrônquicos como dos perivasculares de todos os lobos pulmonares e da região justa-alveolar, desempenha um papel crucial na remoção de materiais estranhos e na disseminação dos tumores do pulmão1–5.
Os liposomas foram propostos como promissores sistemas de transporte de fármacos anti-tumorais, devido à sua capacidade de encapsulamento6,7. São igualmente adequados para a obtenção de imagens da rede linfática profunda, uma vez que se comportam como partículas estranhas e são drenados. Podem ser administrados através de várias vias como, por exemplo, sob a forma de aerossóis. Com base na patofisiologia da infecção pulmonar por Bacillus tuberculosis podem modular-se liposomas específicos. Estes liposomas podem ser produzidos para mimetizar a composição da parede de esporos de Bacillus subtilis (um microrganismo saprófita das vias respiratórias), de modo a serem capturados pelos linfáticos pulmonares8,9.
Material e métodosReagentes1A distearoilfosfatidilcolina (DSPC) foi seleccionada como fosfolípido principal (temperatura de transição de fase 56°C) uma vez que permite a produção de liposomas estáveis na presença de fluidos biológicos6,7,10. Como fosfolípido com carga negativa escolheu-se o fosfatidilglicerol (PG)11,12 e o ácido glutâmico (GA) para actuar como resíduo presente quer na camada interna quer na densa camada externa13,14. DSPC, PG, GA e glutationa (GSH) foram adquiridos à empresa Sigma (St. Louis, MO, EUA) e o Sephadex G-25 à Pharmacia (Upsala, Sweden). Como anestésicos utilizaram-se o Ketalar® (Parke Davis, Cape Town, S.A.) e o Sagatal (Kyron Laboratories Pty. Ltd., Benrose, S.A.). O 99mTc foi obtido a partir de um gerador comercial de 99Mo/99mTc (NECSA, África do Sul). A Exametazima (Ceretec™) foi adquirida à G.E. Healthcare (UK). Para determinação da eficiência de marcação e pureza radioquímica usaram-se tiras de ITLC-SG (Gelman Sciences Inc., Ann Arbor, EUA) e de papel Whatman n° 1.
Produção de liposomasA formulação liposomal é constituída por DSPC:PG:GA, respectivamente na proporção molar de 8:1:1. A mistura lipídica, com uma concentração de 50mg/ml, foi dissolvida em 2ml de clorofórmio num balão de fundo redondo. Efectuou-se a sua evaporação à temperatura ambiente, sob pressão reduzida e atmosfera inerte, durante 2h, para formar um fino filme lipídico que foi seco durante a noite sob vácuo15. 100mM de GSH reduzido (em soro fisiológico a 0,9%) foram adicionados aos referidos filmes através de agitação em vórtex forte16–19. O balão foi colocado em banho-maria a 65°C durante 10min, para promover a hidratação do filme lipídico.
Os liposomas multilamelares, produzidos por este método, foram depois extrusados a 70°C através de 2 filtros de policarbonato sobrepostos (Nucleopore, CA, EUA) com poros de 100nm, montados num mini-extrusor (LiposoFast™, Avestin, Canada) acoplado a duas seringas Hamilton de 0,5ml (Hamilton, NV, EUA)20–22. De modo a obter liposomas unilamelares com um pequeno índice de polidispersão, os liposomas multilamelares foram passados pelos filtros 20 vezes23.
Para remover todo o GSH extravesicular presente, a suspensão liposomal (500μl de cada vez) foi eluída através de minicolunas cromatográficas de exclusão molecular de Sephadex G-25 à temperatura ambiente, acopladas a filtros Durapore® (Millipore, Ireland) com poros de 0,45μm23–26. As minicolunas foram lavadas com soro fisiológico a 0,9% e pH=7,4 com um fluxo de±21ml/h15,22,27.
Protocolo de marcaçãoA marcação dos liposomas foi efectuada de acordo com o protocolo de Phillips et al.18. Kits de Ceretec® (contendo 0,5mg de Exametazima, 7,6μg de SnCl2 e 4,5mg de NaCl) foram reconstituídos com 740 MBq (20 mCi) de 99mTc em 1ml de NaCl a 0,9% e incubados durante 5min.
De acordo com o fabricante usou-se um sistema de 3 tiras de ITLC para testar a marcação do complexo lipofílico de 99mTc-Exametazima, em relação aos contaminantes pertecnetato livre, 99mTc reduzido hidrolisado e complexo hidrofílico28. Apenas os kits com uma marcação do complexo lipofílico 99mTc-Exametazima superior a 80% foram usados para radiomarcação dos liposomas.
Aproximadamente 3ml da suspensão liposomal foram adicionados a 0,5ml de 99mTc-Exametazina. 10min após a incubação, os liposomas foram separados do 99mTc livre por filtração através de uma coluna de Sephadex G-25. A eficiência de marcação do 99mTc-Exametazima-liposomas foi determinada por ITLC-SG com soro fisiológico a 0,9% como solvente. Neste sistema os liposomas permanecem na origem da tira, enquanto os contaminantes sobem com a frente do solvente28–30.
Determinação do diâmetro dos liposomas e carga de superfícieA carga de superfície dos liposomas foi determinada por velocimetria de laser Doppler, usando um Coulter Delsa 440 com 4 graus de incidência luminosa: 34,7°; 26°; 17,4° e 8,7°. Os dados obtidos foram usados para calcular a mobilidade electroforética e o potencial zeta das amostras.
A distribuição das vesículas por tamanho foi determinada por espectroscopia de dispersão dinâmica da luz ou correlação fotónica com um Coulter N4 Plus31,32. O coeficiente de difusão obtido foi usado para calcular o raio hidrodinâmico médio e, assim, o diâmetro médio das partículas32,33.
Estudos de estabilidadeA permeabilidade da membrana liposomal foi avaliada in vitro ao longo do tempo por ITLC-SG com soro fisiológico a 0,9%. A diminuição da eficiência de marcação, isto é, a perca de conteúdo aquoso, pode ser usada como um índice de integridade de membrana.
A estabilidade liposomal foi determinada através de dois métodos: a) incubação a 37°C com: soro fisiológico, soro humano, plasma humano e uma solução de albumina sérica humana (4mg/ml), fracções sanguíneas frescas e após desactivação do complemento (56°C, 30min), sendo os controlos o soro fisiológico e a solução de albumina sérica humana6,34; b) ITLC-SG com soro fisiológico a cada 30min, durante 5,5h após uma segunda cromatografia de exclusão molecular com Sephadex G-25.
Os efeitos dos ultra-sons (frequência=2,7MHz) sobre a integridade da membrana liposomal foram também testados. Os liposomas foram avaliados antes e 3min após a nebulização por microcromatografia, usando o sistema previamente descrito35–37.
Produção e administração de aerossóisOs aerossóis foram produzidos usando um nebulizador ultrasónico (Heyer Ultraschall Verebler 69, Germany) que gera US (ultra-sons) com uma frequência de 2,7MHz 2.
Os aerossóis heterodispersos foram administrados directamente aos babuínos através de um tubo endotraqueal inserido na sua traqueia (4 machos adultos, 25 – 27kg), até se obterem 2.000 Kcontagens/min no campo total da câmara gama (±3min). Os animais foram mantidos anestesiados durante todo o estudo. Para induzir a anestesia utilizou-se Ketalar® (10mg/Kg, i.m.), imediatamente seguida de uma infusão controlada de Sagatal® (25-30mg/Kg com um fluxo de 30ml/h, i.v.).
A bexiga de todos os animais foi mantida cateterizada durante a duração do exame, para drenar a urina e permitir uma melhor aquisição das imagens pélvicas.
A dose radioactiva efectivamente inalada (74 a 148 MBq) foi determinada usando um calibrador (Capintec) para medir a solução radiomarcada que permaneceu no nebulizador após a aerossolização e comparando-o com o valor inicial.
O protocolo para os estudos in vivo foi aprovado pelo Comité de Ética da Universidade de Pretória, de acordo com as directivas da legislação nacional para a utilização de animais em investigação, ensino, diagnóstico e testes de fármacos e substâncias relacionadas na África do Sul3.
Estudos de biodistribuiçãoOs estudos de biodistribuição foram efectuados em quatro babuínos (Papio ursinus) colocados em decúbito dorsal na câmara gama (Siemens Orbiter, Siemens, Erlangen, Germany), após estudos preliminares em Sus scrofa38. Para a aquisição das imagens dinâmicas (matriz 64x64, 1 frame/min durante 30min) o colimador foi colocado sob o tórax. A aquisição foi sincronizada com a inalação dos 99mTc-Exametazima-liposomas. Uma série de imagens estáticas (matriz 128x128, 2min/frame) do tórax e da zona pélvica foi adquirida 30, 60, 90 e 120min pós-inalação.
Uma linfocintigrafia indirecta foi efectuada num babuíno, para confirmar a localização dos gânglios linfáticos inguinais. 18,5 MBq de 99mTc- Re2S7 foram injectados no primeiro espaço interdigital de ambas as patas posteriores para efectuar uma aquisição dinâmica de 30min (matriz 64x64, 1 frame/min) da pelvis. Imediatamente após foi adquirida uma imagem estática pélvica (matriz 128x128), fazendo movimentos passivos de ambas as patas.
Como controlo um babuíno inalou um aerossol de 99mTc-Exametazima. A aquisição dinâmica e as imagens estáticas foram efectuadas segundo o protocolo atrás referido. Estas imagens foram usadas para subtracção de fundo (background) nas imagens com 99mTc-Exametazima-liposomas.
As ROIs foram desenhadas nas imagens dinâmicas sobre os pulmões, coração, gânglios linfáticos axilares, fígado, rim e bexiga. Para obter informação biocinética foram obtidas curvas de actividade-tempo.
Metodologia estatísticaOs dados são apresentados sob a forma de médias±desvio padrão. Foi aplicado o teste t-Student às médias, considerando uma diferença estatisticamente significativa para p<0,05.
ResultadosA metodologia utilizada permitiu a produção de vesículas unilamelares (diâmetro médio - D50 - 100nm) com um pequeno índice de polidispersão (0,17; n=3), e uma carga de superfície de – 45,8mV (n=3), confirmada pela determinação do potencial zeta e por espectroscopia de correlação fotónica.
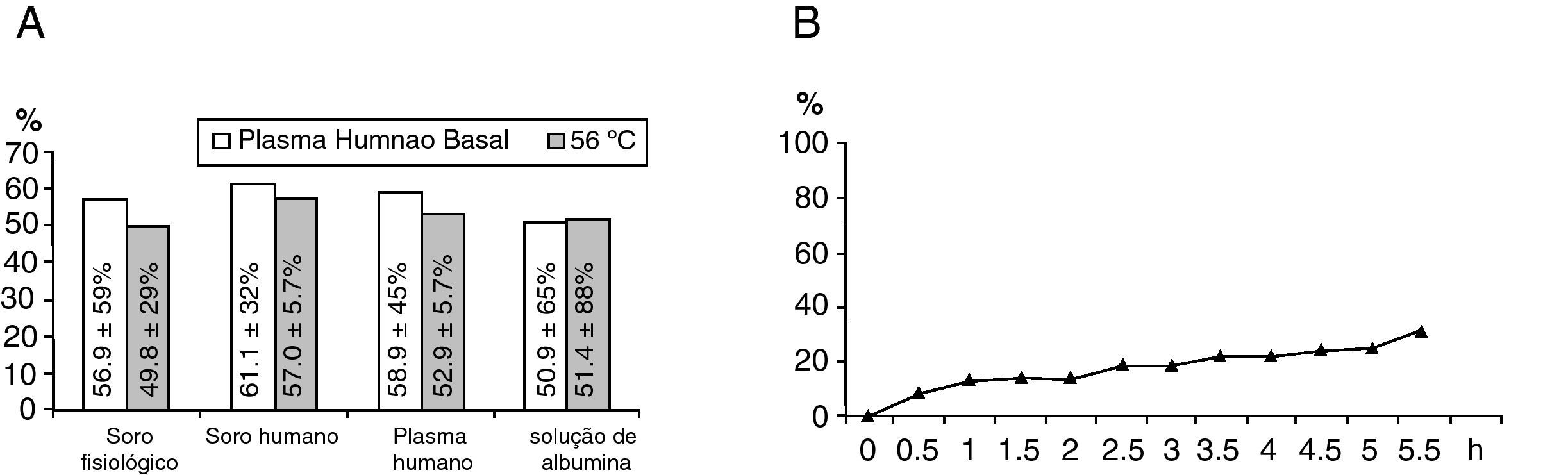
A eficiência de marcação da formulação liposomal foi testada com microcromatografia instantânea ascendente de camada fina (ITLC-SG) com soro fisiológico. A média de eficiência de marcação obtida para 99mTc-Exametazima foi de 74,1±13,9% (n=12). Os estudos de estabilidade in vitro previamente referidos mostram-se na figura 1A. A eficiência de marcação de 99mTc-Exametazima-liposomas foi boa, mas a característica mais importante foi a sua estabilidade in vitro na presença de soro humano, plasma humano e solução de albumina ser superior à estabilidade nas fracções sanguíneas.
Estabilidade dos liposomas. A) A eficiência de marcação (%) após incubação com diferentes fluidos (soro fisiológico, soro humano, plasma, solução de albumina humana com uma concentração de 4mg/ml), antes e após o aquecimento a 56°C por 30min, para inactivar o complemento das fracções sanguíneas. B) Avaliação temporal da perda do núcleo aquoso pelos liposomas, utilizando ITLC-SG ascendente com soro fisiológico.
A formulação liposomal foi administrada sob a forma de aerossol e a sua eficiência de marcação (após 3min de acção dos US) não foi significativamente diferente dos valores determinados pré- e pós-exposição aos US. O estudo da perca de conteúdo aquoso, durante 5,5h após o segundo ITLC-SG, mostrou uma boa estabilidade antes e depois da ultrasonicação (fig. 1B).
Os estudos cintigráficos dinâmicos, tanto com a inalação de aerossóis de 99mTc-Exametazima como com 99mTc-Exametazima-liposomas, mostraram uma boa deposição no pulmão, confirmando que os liposomas produzidos atingem as vias respiratórias de pequeno calibre e, assim, a superfície alveolar.
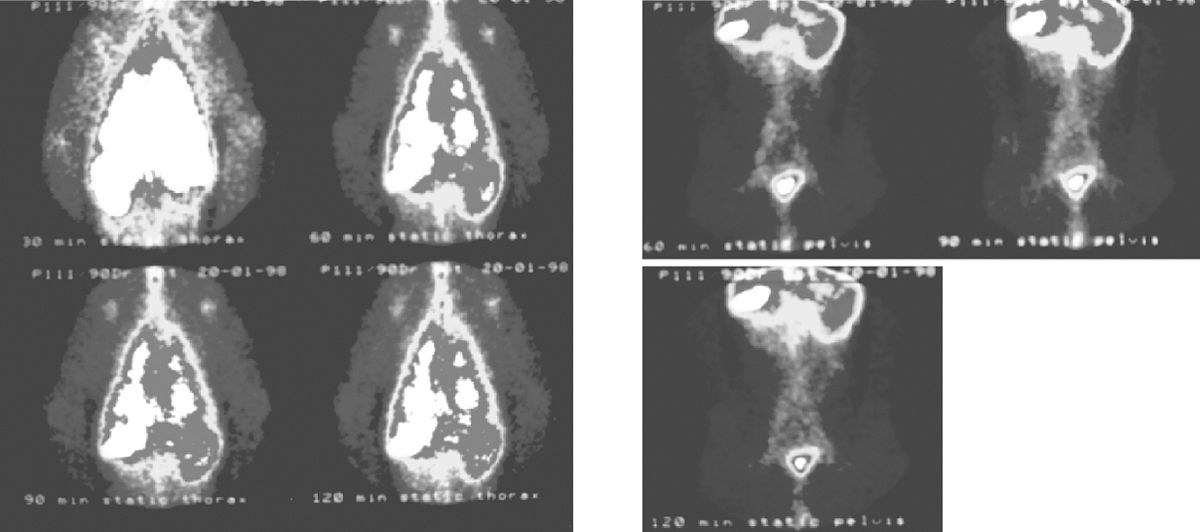
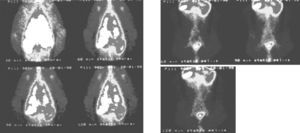
Os gânglios linfáticos axilares foram visualizados 30min pós-inalação. 1h pós-inalação tornaram-se mais evidentes e os nódulos linfáticos aórticos abdominais e inguinais foram também observados. Imagens tardias não trouxeram informação adicional, embora se observe actividade nos órgãos abdominais (fig. 2).
Sequência de imagens obtidas aos 30, 60, 90 e 120min após inalação de 99mTc-Exametazima-liposomas. Para além da deposição pulmonar elevada, observa-se uma grande captação pelos gânglios axilares. Nas imagens abdominais aos 60, 90 e 120min observam-se nódulos linfáticos da cadeia da aorta abdominal e das cadeias inguinais.
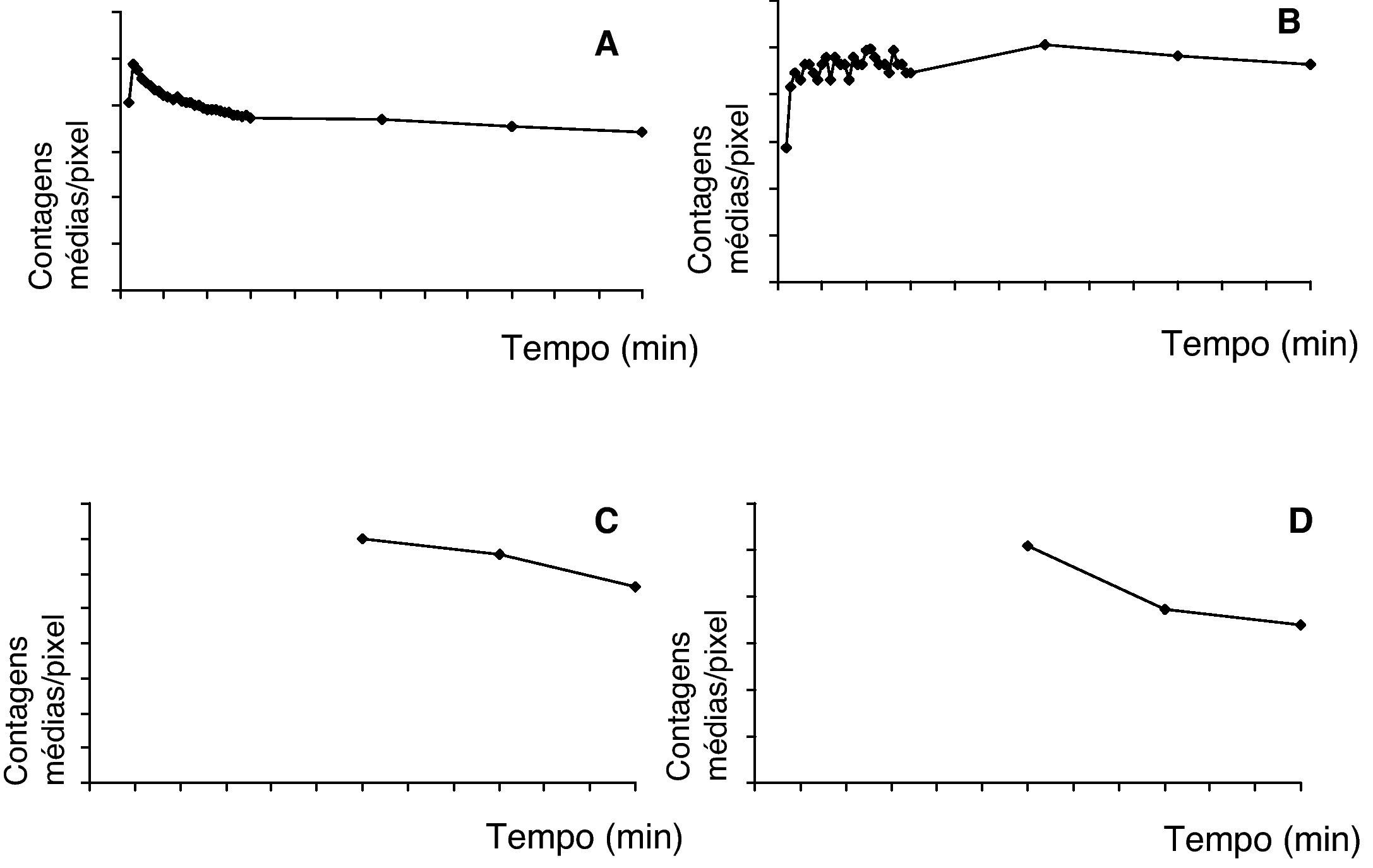
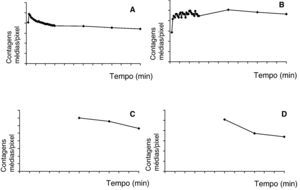
A actividade média/pixel em cada ROI, após correcção de background e de decaimento, foi usada para obter curvas de actividade-tempo regionais, mostrando as variações biocinéticas do radiotraçador em determinadas zonas alvo durante o estudo (fig. 3). A actividade total foi medida nos pulmões pós-inalação, bem como a taxa de desaparecimento (t1/2=77min) (fig. 3A). Um aumento de actividade foi simultaneamente observado nos gânglios linfáticos axilares, atingindo valores máximos para os nódulos axilares e inguinais±60min (fig. 3B-D).
Curvas tempo-actividade que representam a cinética do 99mTc-Exametazima-liposomas nos pulmões (A), gânglios axilares (B), gânglios periaórticos (C) e gânglios inguinais (D). Os gráficos C e D começam apenas aos 60min, uma vez que a dimensão do colimador não permite uma aquisição dinâmica simultânea a nível do tórax e do abdómen.
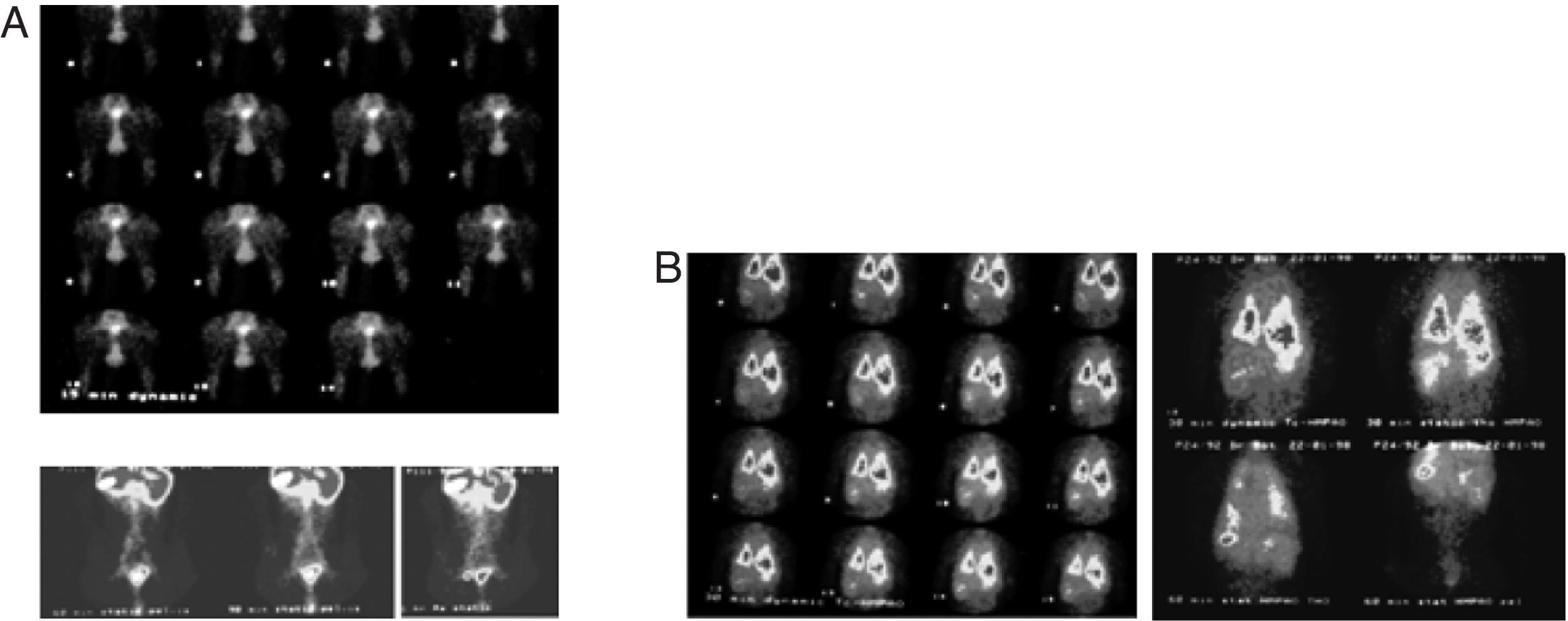
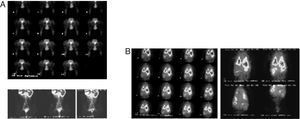
Promovendo movimento passivo das patas posteriores, após injecção de uma solução de 99mTc-Re2S7, o nódulo linfático inguinal esquerdo foi visualizado aos 45min, correspondendo à área visualizada com 99mTc-Exametazima-liposomes (fig. 4A). No animal controlo, a biodistribuição da 99mTc-Exametazima mostrou um rápido desaparecimento dos pulmões através da permeabilidade alveolo-capilar, o que permitiu uma rápida visualização de vários órgãos (fígado, vesicular biliar, baço, rins e cólon ascendente e transverso) (Product datasheet, Ceretec®, 2001). No entanto, os gânglios linfáticos não eram evidentes, uma vez que a actividade abdominal mascara as cadeias linfáticas abdominais (fig. 4B).
Imagens dos animais-controlo. A sequência de imagens dinâmicas da linfocintigrafia indirecta obtida durante os primeiros 30min após injecção interdigital patas posterioresde 99mTc-Re2S7, bem como imagens estáticas aos 60, 90 e 120min. A drenagem linfática abdominal observada corresponde às áreas visualizadas com liposomas marcados com 99mTc-Exametazima. B. A biodistribuição de 99mTc-Exametazima é um controlo e não permite visualizar os nódulos linfáticos nem cadeias linfáticas abdominais. Apenas se observa actividade torácica e abdominal difusa.
De acordo com os princípios MIRD4, e aplicando o método da fracção absorvida para calcular a dose absorvida, os valores obtidos foram semelhantes aos usados nos exames de rotina de Medicina Nuclear convencional para avaliação da permeabilidade alveolo-capilar com aerossóis39,40.
DiscussãoA rede linfática pulmonar desempenha um papel fundamental na taxa de desaparecimento a nível alveolar e intersticial, sendo responsável pela remoção de muitas substâncias, partículas, poeiras ou agentes patogénicos. A drenagem linfática preferencial correlaciona-se com componentes de superfície específicos, tais como os que estão presentes em microrganismos.
Este trabalho de investigação descreve os resultados obtidos em estudos animais in vivo realizados em babuínos, utilizando a referida formulação (99mTc-Exametazima-liposomas), administrados sob a forma de aerossol, como um agente de diagnóstico por imagem para visualização da drenagem linfática profunda do pulmão.
Este sistema transportador poderá ser usado para visualização e/ou terapia, consoante encapsular um agente imagiológico ou um fármaco para terapia. Dado que os componentes aniónicos são rapidamente removidos pela rede linfática, os liposomas unilamelares de pequenas dimensões e negativamente carregados foram produzidos por extrusão através de membranas de policarbonato com poros de 100nm41.
Uma vez que o 99mTc tem um período de meia vida de 6h, a marcação da fase aquosa dos liposomas foi efectuada após a sua produção e imediatamente antes da administração7,11,18,23,24,34,42. Foi efectuada a extrusão sob pressão moderada, dado que a inalação liposomal implica a ausência de solventes orgânicos ou detergentes na solução, para evitar possíveis reacções alérgicas11.
A estabilidade in vivo dos liposomas pode ser alterada pela agressão do complemento, dependendo da composição lipídica da membrana10. Para avaliar estes efeitos disruptivos foi testada a estabilidade in vitro de 99mTc-Exametazima-liposomas através da incubação com soro fisiológico, soro humano fresco, plasma e albumina sérica humanos (4mg/ml), tal como anteriormente foi descrito. Os resultados mostram um aumento estatisticamente significativo da eficiência de marcação na presença de soro e plasma humanos para a formulação estudada (t=3,2; p=0,01). Isto demonstra que os fluidos biológicos não induziram perca do conteúdo aquoso dos liposomas. A estabilidade à ultrasonicação foi determinada analisando a eficiência de marcação após a acção de US a 2,7MHz. Os resultados não mostram diferenças estatisticamente significativas para as eficiências de marcação pré e pós-acção dos US, como foi previamente mencionado por outros autores37,41–45.
A estabilidade liposomal foi também estudada em termos de perca de conteúdo encapsulado (fig. 1B) durante 5,5h. Os resultados mostram uma perca progressiva do conteúdo aquoso, provavelmente devida à constituição lipídica.
O aerossol liposomal inalado atingiu a membrana alveolo-capilar pulmonar. As vesículas podem ser removidas porque atravessam a superfície alveolar para o interstício pulmonar após fagocitose pelos macrófagos alveolares ou mesmo directamente através dos espaços intercelulares ou pela via mucociliar. Os liposomas que atravessaram o interstício foram eliminados por drenagem linfática para os gânglios linfáticos e, subsequentemente, pelos vasos capilares sanguíneos46–48.
Anatomicamente, os linfáticos pulmonares podem ser agrupados em duas redes interligadas: a superficial pleural, localizada no tecido conjuntivo da pleura visceral, e uma profunda intrapulmonar, que forma os linfáticos peribronquiovasculares, localizada no tecido conjuntivo dos folhetos das árvores brônquica e vascular. Podem ver-se vários capilares linfáticos nas áreas justa-alveolares, em continuidade com a parede alveolar e separados do lúmen alveolar apenas pelo epitélio alveolar e tecido conjuntivo de suporte (geralmente muito fino e ricamente vascularizado). Os linfáticos pulmonares existem também no tecido conjuntivo laxo de suporte das células pleurais periféricas, cobrindo os lobos pulmonares, septos interalveolares e folhetos perivasculares3–5,41,49.
O mecanismo de remoção também depende das características fisico-químicas e tamanho das partículas. Apenas tamanhos submicrométricos (< 50nm Ø) podem ser depositados na superfície alveolar, sendo drenados posteriormente pelo sistema linfático50. Ao atingir a superfície alveolar, os 99mTc-Exametazima-liposomas atravessam para o interior dos capilares linfáticos das áreas justa-alveolares através dos espaços intercelulares e são englobados pelos macrófagos alveolares, migrando então para os nódulos linfáticos do hilo3–5,41,49,51. No nosso modelo animal, a dose radioactiva relativamente grande depositada nos pulmões não ajudou a identificar estes nódulos. No entanto, a principal via de drenagem linfática de todo o órgão está ligada aos nódulos linfáticos mediastínicos e abdominais periaórticos, pelo que a sua visualização nas imagens está de acordo com os dados anatómicos (fig. 2)1–5,41,49,51. Existe uma drenagem linfática rápida infra-abdominal pós-inalação, confirmada pela linfocintigrafia indirecta. Esta taxa de desaparecimento pode provavelmente explicar as metástases à distância dos tumores do pulmão que aparecem em locais menos comuns.
ConclusõesOs aerossóis de 99mTc-Exametazima-liposomas especialmente construídos provou ser uma aproximação interessante para o estudo da drenagem linfática profunda do pulmão. O comportamento fisiológico deste sistema transportador de fármacos, que mimetiza algumas propriedades de microrganismos, permitiu visualizar a via linfática descendente para as cadeias ganglionares aórticas abdominais, confirmando-se pela linfocintigrafia indirecta. Imagens destas cadeias podem ser bastante relevantes no estadiamento de tumores do pulmão, bem como na avaliação de outras patologias com contribuição importante da via linfática pulmonar. Além disso, esta metodologia pode desempenhar um papel importante na libertação controlada dirigida para um alvo específico de outros fármacos, como por exemplo agentes terapêuticos citotóxicos.
Tendo em vista os resultados promissores obtidos nos modelos animais testados, perspectiva-se a produção de um sistema traçador, para administração por via inalatória, que forneça informação sobre o grau de invasão e metastização através de imagens funcionais.
Todos os reagentes não especificados no texto são de grau de pureza analítica ou equivalente.
A água do reservatório foi arrefecida a 5 – 6°C, de modo a minimizar os efeitos do aumento da temperatura produzidos pelos US.
- Home
- All contents
- About the journal
- Metrics
- Open access