O lavado broncoalveolar (LBA) com culturas quantitativas tem sido utilizado no sentido de permitir um aumento da especificidade diagnóstica da pneumonia associada ao ventilador (PAV), embora a técnica padrão para o diagnóstico definitivo desta entidade permaneça controversa.
ObjectivosAvaliar a influência dos resultados positivos do LBA e das culturas quantitativas no diagnóstico microbiológico e no tratamento de doentes com suspeita de PAV tardia e antibioterapia prévia.
Material e MétodosAnálise retrospectiva de doentes em unidade de cuidados intensivos (UCI) polivalentes, com suspeita de PAV tardia e antibioterapia prévia, que apresentaram crescimento cultural nos LBA efectuados durante o período de um ano.
ResultadosDos 243 LBA realizados, obtiveram-se 71 (29,2%) resultados positivos (60 doentes, 76,7% do sexo masculino, 54±19 anos). O LBA foi realizado em mediana após 13 dias de ventilação invasiva, 11 dias de antibioterapia na UCI e no dia em que se instituiu um novo antibiótico perante a suspeita de PAV. Foi efectuada contagem de unidades formadoras de colónias (UFC)/ml em 71,8% e simultaneamente obtido aspirado endotraqueal (AET) para análise qualitativa em 85,9%. Verificou-se mudança terapêutica em 38,0%: correcção terapêutica (16,9%), descalação (12,7%) e início de antibioterapia dirigida (8,4%). As alterações terapêuticas foram efectuadas na presença de >104 UFC em 84,2% e em concordância com o AET em 70,8%. Nos casos em que se verificou manutenção da antibioterapia (62,0%) as culturas quantitativas teriam permitido descalação em 9,1%. A alteração na prescrição foi mais frequente na presença de >104 UFC (48,5%), do que nas situações em que as contagens de UFC foram inferiores ou a análise do LBA qualitativa (28,9%), p=0,091. Não se verificaram diferenças significativas entre os doentes submetidos às diferentes atitudes terapêuticas no que diz respeito à mortalidade na UCI ou duração do internamento.
ConclusãoNa PAV tardia, o resultado positivo do LBA e das culturas quantitativas condicionnou mudanças terapêuticas, no sentido da adequação da antibioterapia e da redução do consumo de antibióticos, que podem contudo ser maximizadas.
Bronchoalveolar lavage (BAL) with quantitative cultures has been used in order to increase ventilator associated pneumonia (VAP) diagnosis specificity, although the accurate technique for this entity diagnosis remains controversial.
ObjectivesTo evaluate the influence of using positive BAL and quantitative cultures results in microbiologic diagnosis and treatment of patients with suspected late VAP and prior antibiotherapy.
Material and MethodsRetrospective analysis of intensive care unit (UCI) patients, during a one year period, with clinical suspicion of late VAP and prior use of antibiotics that presented a growth in BAL cultures.
ResultsOf 243 BAL performed, there were 71 (29.2%) positive cultures (60 patients, 76.7% male, 54±19years). BAL was done after 13days (median) of invasive mechanical ventilation, 11days of ICU antibiotherapy and in the day in which a new antibiotic for VAP suspicion was started. Colony forming units (CFU)/ml count was performed in 71.8% and endotracheal aspirate (ETA) simultaneously collected for qualitative analysis in 85.9%. Therapeutic approach was changed in 38.0%: correction (16.9%), de-escalation (12.7%) and directed antibiotherapy start (8.4%). Therapeutic changes were made in the presence of CFU>104 in 84.2% and in agreement with ETA in 70.8%. In cases in which antibiotherapy was maintained (62.0%), quantitative cultures would have allowed de-escalation in 9.1%. Changes in prescription were more frequent when CFU was >104 (48.5%), comparing with situations in which counts were lower and BAL analysis was qualitative (28.9%), p=0.091. There were no significant differences between patients submitted to different therapeutic approaches concerning to ICU mortality or length of stay.
ConclusionIn late onset VAP, positive BAL and quantitative cultures allowed therapeutic changes, leading to antibiotic adequacy and consumption reduction, which can however be maximised.
A pneumonia associada ao ventilador (PAV) constitui a principal infecção nosocomial adquirida em unidades de cuidados intensivos (UCI), podendo ocorrer entre 8 a 28%1 dos doentes sob ventilação mecânica invasiva (VMI) por um período igual ou superior a 48 horas. É também um factor independente de mortalidade, com uma mortalidade atribuível estimada de 20 a 30%2.
O diagnóstico da PAV permanece um desafio para o clínico, sendo fundamental para a instituição de antibioterapia precoce e apropriada, pressupostos que estão significativamente relacionados com a diminuição da mortalidade hospitalar3,4.
A abordagem diagnóstica clínica, baseada na conjugação de critérios clínicos, radiológicos e laboratoriais5, demonstrou, contudo, valores de sensibilidade e especificidade (69% e 75%, respectivamente) inferiores aos desejáveis6, conduzindo frequentemente a uma sobrestimativa da incidência da doença dada a dificuldade em diferenciar colonização de infecção e em diferenciar entre as diferentes etiologias não infecciosas que podem mimetizar os achados encontrados na PAV.
A acrescentar à dificuldade diagnóstica, a selecção da antibioterapia na PAV deve ter em conta os diferentes que aumentam o risco de infecção por agentes multirresistentes particularmente implicados na etiologia das pneumonias tardias7,8. Torna-se portanto, fundamental obter um diagnóstico microbiológico assertivo, que permita aumentar a especificidade do diagnóstico da PAV e a adequação da terapêutica inicial e que permita, sempre que possível, a redução do consumo de antibióticos, com consequente diminuição dos seus efeitos laterais e pressão de selecção.
Neste contexto, têm sido utilizadas diferentes abordagens na investigação microbiológica, nomeadamente as invasivas como o lavado broncoalveolar (LBA) e as culturas quantitativas. Contudo, os dados da literatura são controversos no que diz respeito ao valor dos dois tipos de abordagens e apesar de duas décadas de investigação, continua a não existir uma técnica padrão para o diagnóstico definitivo da PAV.
As culturas quantitativas têm sido utilizadas com o objectivo ajudar a contornar a dificuldade em distinguir colonização de infecção. O limiar de 104 unidades formadoras de colónias por mililitro (UFC/ml) no LBA apresenta valores de sensibilidade e especificidade que variam entre 42–93% e 45–100%, respectivamente, superiores aos descritos para o limiar de 106 UFC/ml do aspirado endotraqueal (AET), entre 36–82% e 72–85%7.
De entre os vários estudos que comparam o impacto das técnicas invasivas com culturas quantitativas com as não invasivas9–18, apenas cinco são randomizados e controlados12–16. Um grupo francês, demonstrou existirem diferenças estatisticamente significativas, com mais dias livres de antibióticos e maior sobrevivência ao 14.° dia, nos doentes incluídos no grupo das técnicas invasivas15. Posteriormente, uma meta-análise concluiu que o uso de técnicas invasivas influenciava a prescrição antibiótica, mas não a mortalidade19. Mais recentemente, um estudo canadiano concluiu não haver diferenças no uso de antibioterapia e nos outcomes entre aos diferentes tipos de abordagens16.
A variabilidade no delineamento dos estudos, o seu frequente reduzido poder amostral e a heterogeneidade dos critérios aplicados às populações podem em parte explicar a diversidade de resultados encontrados na literatura17–19.
Apesar da controvérsia, parece existir evidência científica demonstrando benefício na utilização das técnicas invasivas, que são recomendadas em alguns documentos de consenso7,8, nomeadamente se reunidas as condições de exequibilidade do procedimento e a rentabilidade da amostra biológica8.
Os autores efectuaram um estudo preliminar com o objectivo principal de avaliar a influência dos resultados culturais positivos do LBA e das culturas quantitativas no diagnóstico microbiológico e no tratamento de doentes com suspeita de PAV tardia e antibioterapia prévia. Como objectivo secundário, os autores analisaram a mortalidade na UCI e a duração do internamento.
Material e MétodosFoi efectuada uma análise retrospectiva dos processos clínicos de doentes admitidos nas duas UCI polivalentes de adultos (28 camas) de um hospital universitário, que apresentaram culturas positivas nos LBA, efectuados no período de 1 ano (Setembro 2007–2008).
Todos os doentes apresentavam suspeita clínica de PAV, estavam internados há mais de quatro dias e tinham efectuado terapêutica antibiótica prévia (duração mínima de dois dias, profilaxia incluída).
A suspeita diagnóstica era colocada perante um infiltrado radiológico de novo ou agravado associado a pelo menos dois dos seguintes três critérios: purulência das secreções respiratórias, temperatura corporal superior a 38° C ou inferior a 36° C, leucocitose superior a 10.000/mm3 ou leucopenia inferior a 4.000/mm37,8.
O LBA foi obtido por broncofibroscopia (BFC) de acordo com o seguinte protocolo: 1) sedação adequada com/sem curarização; 2) pré-oxigenação (Fi02 a 100%); 3) introdução do broncofibroscópio através do tubo endotraqueal usando um adaptador específico; 4) evicção da aspiração e do uso de anestésico local; 5) encravamento do broncofibroscópio num brônquio subsegmentar com correspondência com a área radiológica envolvida; 6) instilação sequencial de seis aliquotas (20ml cada) e aspiração manual lenta; 7) rejeição da primeira aliquota; 8) processamento microbiológico do fluido recuperado (mínimo 40-60ml) num período não superior a 1 hora.
O LBA foi analisado de forma quantitativa ou qualitativa. O AET, obtido por técnica asséptica, num intervalo de tempo não superior a 24 horas à realização do LBA foi processado, em todos os casos, de forma qualitativa. Para o estudo, foi considerado como resultado positivo, o decorrente do crescimento de um ou mais microorganismos nos exames culturais quantitativos ou qualitativos destes produtos biológicos.
As considerações terapêuticas basearam-se no protocolo de antibioterapia da UCI. Foram utilizados os conceitos de manutenção e alteração da atitude terapêutica, incluindo a última, as situações de correcção/ajuste da antibioterapia inapropriada, descalação e início de antibioterapia dirigida. Considerou-se inapropriação, a decorrente do isolamento de um microorganismo que não foi previsto no momento da instituição da antibioterapia empírica ou cujo teste de sensibilidade aos antimicrobianos mostrou resistência a pelo menos um, no caso da Pseudomonas a dois, dos antibióticos prescritos. A descalação poderia ter incluído a redução do número de antibióticos, a substituição de antibióticos de largo por outros de menor espectro, a redução da duração ou a suspensão da antibioterapia.
Os resultados foram apresentados como percentagem para as variáveis categóricas e mediana (intervalo interquartil) ou média (± desvio padrão) para as variáveis contínuas. A análise estatística foi efectuada com recurso ao programa SPSS, versão 16.0. Os testes do Qui Quadrado e de Fisher foram utilizados para as variáveis categóricas e os de Mann-Whitney U e Kruskal-Wallis H para as variáveis contínuas. Significância estatística foi considerada para um valor de p<0,005.
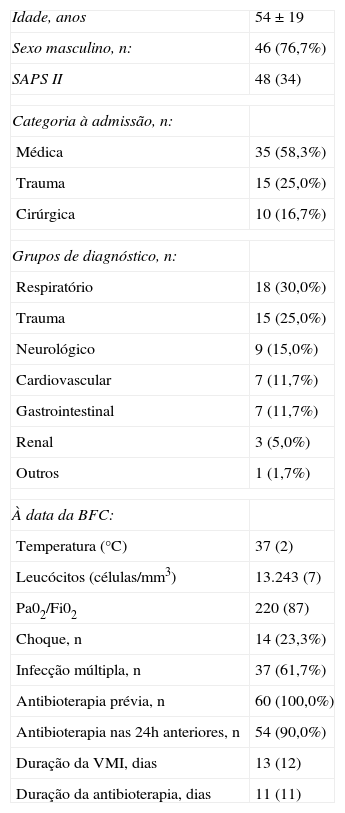
ResultadosCaracterísticas gerais da populaçãoForam analisados 71 resultados culturais positivos do LBA, efectuados em 60 doentes, 76,7% (n=46) do sexo masculino, com uma idade média de 54±19 anos (tabela 1).
Características gerais da população (n=60).
| Idade, anos | 54±19 |
| Sexo masculino, n: | 46 (76,7%) |
| SAPS II | 48 (34) |
| Categoria à admissão, n: | |
| Médica | 35 (58,3%) |
| Trauma | 15 (25,0%) |
| Cirúrgica | 10 (16,7%) |
| Grupos de diagnóstico, n: | |
| Respiratório | 18 (30,0%) |
| Trauma | 15 (25,0%) |
| Neurológico | 9 (15,0%) |
| Cardiovascular | 7 (11,7%) |
| Gastrointestinal | 7 (11,7%) |
| Renal | 3 (5,0%) |
| Outros | 1 (1,7%) |
| À data da BFC: | |
| Temperatura (°C) | 37 (2) |
| Leucócitos (células/mm3) | 13.243 (7) |
| Pa02/Fi02 | 220 (87) |
| Choque, n | 14 (23,3%) |
| Infecção múltipla, n | 37 (61,7%) |
| Antibioterapia prévia, n | 60 (100,0%) |
| Antibioterapia nas 24h anteriores, n | 54 (90,0%) |
| Duração da VMI, dias | 13 (12) |
| Duração da antibioterapia, dias | 11 (11) |
Definições: SAPS II: simplified acute physiology score II; BFC: broncofibroscopia; Fi02: fracção inspirada de oxigénio; VMI: ventilação mecânica invasiva.
Em 9 doentes foi efectuado um segundo LBA, e em 2 destes, um terceiro LBA (intervalo mediano global de tempo de 12 (15) dias).
O LBA foi realizado em mediana após 13 (12) dias de VMI, 11 (11) dias de antibioterapia na UCI e, no dia 1 (5) em que se instituiu um novo tratamento antibiótico perante a suspeita de PAV.
Foi detectado mais do que um foco infeccioso simultâneo em 61,7% (n=37) dos doentes. Cerca de 13,3% (n=8) eram imunocomprometidos.
Todos os doentes tinham sido submetidos a antibioterapia prévia e apenas 10,0% (n=6), não tinham recebido antibióticos nas 24 horas anteriores à realização do LBA.
Resultados microbiológicosNo período de um ano, foram realizados 243 LBA, obtendo-se uma rentabilidade microbiológica de 29,2% (n=71).
Constatou-se crescimento monomicrobiano em 85,9% (n=61) e polimicrobiano nos restantes 14,1% (n=10). Pseudomonas aeruginosa (33,8%, n=24), Enterobacteriaceas (19,7%, n=14) e Staphylococcus aureus resistente à meticilina (SAMR) (16,9%, n=12) foram os microorganismos mais frequentemente isolados, seguidos dos Fungos (15,5%, n=11 (Candida spp. (n=10), Aspergillus spp. (n=1))). Outros incluíram, Acinetobacter baumannii (4,2%, n=3), Staphylococcus aureus meticilino sensível (4.2%, n=3), Enterococcus faecium (2,8%, n=2), Haemophilus influenzae (1,4%, n=1) e Stenotrophomonas malthophilia (1,4%, n=1).
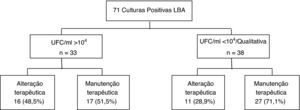
O AET foi simultaneamente obtido em 85,9% (n=61). Em 71,8% (n=51) dos LBA foi efectuada contagem de UFC/ml: >104 em 46,5% (n=33), entre 104-103 em 19,7% (n=14) e<103 em 5,6% (n=4). Nos restantes 28,2% (n=20) dos LBA, o processamento foi efectuado de forma qualitativa.
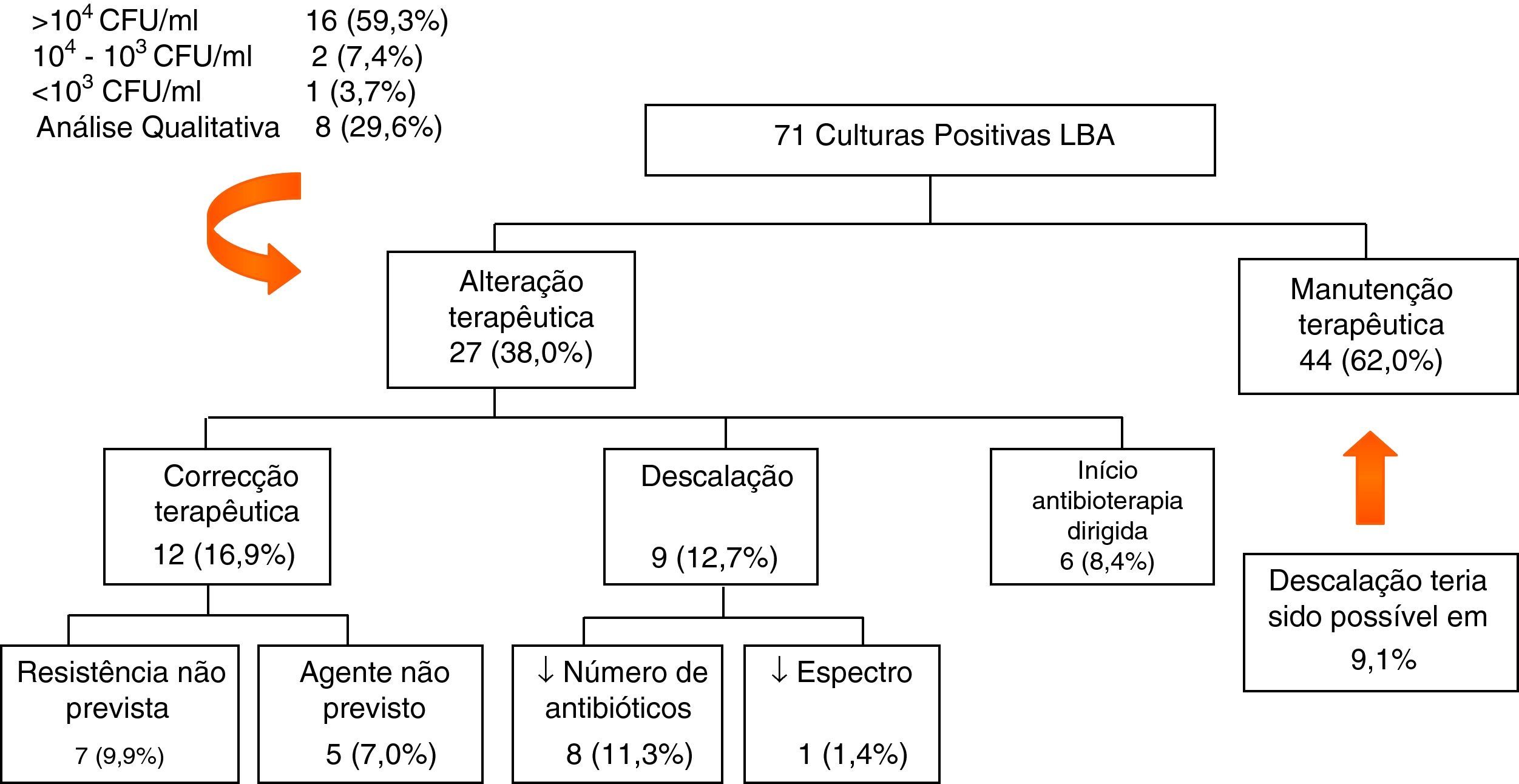
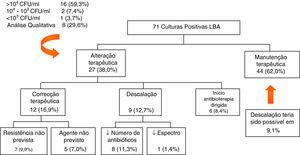
Atitude terapêuticaApós conhecimento do resultado cultural positivo do LBA verificou-se manutenção da atitude terapêutica em 62,0% (n=44) e alteração em 38,0% (n=27), nomeadamente, correcção/ajuste da terapêutica em 16,9% (n=12), descalação em 12,7% (n=9) e início de antibioterapia dirigida em 8,4% (n=6) (fig. 1).
Em 59,3% (n=16/27) dos casos em que se procedeu a alteração da atitude terapêutica a contagem de UFC/ml foi >104, em 7,4% (n=2/27) entre 104-103, em 3,7% (n=1/27) <103 e em 29,6% (n=8/27) baseou-se na análise qualitativa do LBA. A alteração à prescrição terapêutica ocorreu mediante concordância entre o resultado cultural do LBA e dos AET em 63,0% (n=17/27), discordância em 25,9% (n=7/27) e em 11,1% (3/27) não foi possível obter este produto biológico. Analisando estes resultados para a totalidade das culturas quantitativas e dos AET obtidos, constatou-se que as alterações à atitude terapêutica foram efectuadas na presença de >104 UFC/ml em 84,2% (n=16/19) e em concordância como o resultado do AET em 70,8% (n=17/24).
Em todos os casos de realização de mais do que um LBA foi mantida a atitude terapêutica, com excepção de um segundo LBA, em que foi efectuada descalação.
A correcção/ajuste da antibioterapia inapropriada decorreu em 58,3% (n=7/12) de uma resistência aos antimicrobianos não prevista (Ps. aeruginosa [n=4], A. baumannii [n=1] Enterobacteriacea [n=1] e Enterococcus spp. [n=1]) e em 41,7% (n=5/12) do isolamento de um agente microbiológico que não foi inicialmente previsto (fungos [n=3], SAMR [n=1] e Enterobacteriacea [n=1]).
Klebsiella e Enterobacter spp., isolados em dois doentes sob antibioterapia com uma Aminopenicilina, foram as Enterobacteriaceas implicadas respectivamente nos casos acima descritos. Candida e Aspergillus spp. isolados em doentes com sépsis grave e factores condicionantes de imunossupressão (lúpus eritematoso sistémico, asplenia, infecção HIV) foram os fungos não previstos.
A descalação incluiu, por um lado, a redução do número de antibióticos em 88,9% (n=8/9) (Vancomicina [n=3], Carbapenem [n=2], Quinolona e Aminoglicosideo [n=1], Vancomicina e Aminoglicosideo [n=1] e Colistina [n=1]) e, por outro lado, a substituição de um antibiótico de largo (Ureidopenicilina) por outro de menor espectro (Cefalosporina de terceira geração) em 11,1% (n=1/9).
Em 8,4% (n=6) das situações, optou-se por iniciar antibioterapia dirigida após conhecimento do resultado cultural do LBA: Ps. aeruginosa (n=5) e Enterobacteriacea (n=1).
Nos casos em que se verificou manutenção da antibioterapia, das culturas quantitativas teriam permitido descalação em apenas mais 9,1% (n=4/44).
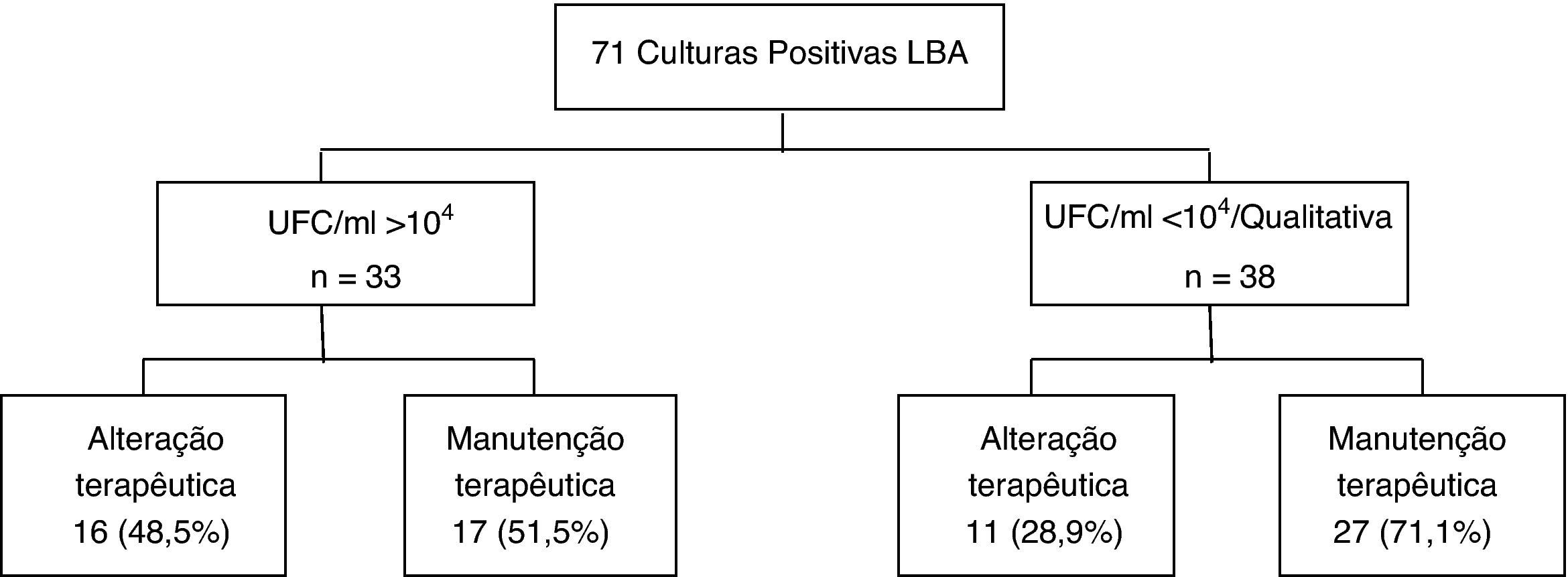
Analisando a influência das culturas quantitativas do LBA na atitude terapêutica, verificou-se que a alteração na prescrição foi mais frequente na presença de contagens de UFC/ml >104 (48,5%, n=16/33), do que nas situações em que as contagens de UFC foram inferiores ou a análise do LBA qualitativa (28,9%, n=11/38), p=0,091 (fig. 2).
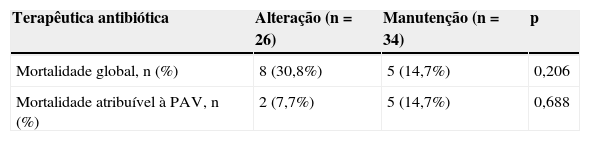
Duração do internamento e mortalidadeA mortalidade global na população de 60 doentes foi 21,7% (n=13). A causa de morte foi directamente atribuída à pneumonia em 14,7% (n=5/34) no grupo em que a terapêutica foi mantida e 7,7% (n=2/26) no grupo em que a mesma foi alterada, p=0,688 (tabela 2).
Mortalidade na UCI de acordo com as diferentes atitudes terapêuticas (n=60).
| Terapêutica antibiótica | Alteração (n=26) | Manutenção (n=34) | p |
|---|---|---|---|
| Mortalidade global, n (%) | 8 (30,8%) | 5 (14,7%) | 0,206 |
| Mortalidade atribuível à PAV, n (%) | 2 (7,7%) | 5 (14,7%) | 0,688 |
Definições: UCI: unidade de cuidados intensivos; PAV: pneumonia associada ao ventilador.
A duração mediana do internamento na UCI foi de 26(17) dias. Foi observada uma maior duração do internamento no grupo alteração (26[18]) versus manutenção da antibioterapia (22[16]), p=0,051. A análise detalhada demonstrou uma tendência sucessivamente decrescente do subgrupo de doentes em que se iniciou antibioterapia dirigida (32[30]), para aqueles em que se efectuou correcção (28[13]), descalação (24[32]) e, por fim, manutenção terapêutica (22[16]), p=0,266 (tabela 3).
Duração do internamento na UCI de acordo com as diferentes atitudes terapêuticas (n=60).
| Terapêutica antibiótica | Alteração (n=26) | Manutenção (n=34) | p | ||
|---|---|---|---|---|---|
| Duração do internamento, (dias) | 26 (18) | 22 (16) | 0,051 | ||
| Correcção | Descalação | Início | |||
| 28 (13) | 24 (32) | 32 (30) | 22 (16) | 0,266 | |
Definições: UCI: unidade de cuidados intensivos; PAV: pneumonia associada ao ventilador.
O estudo preliminar apresentado pelos autores permitiu constatar que nesta população de doentes com suspeita de PAV tardia e antibioterapia prévia, os resultados positivos do LBA e das culturas quantitativas condicionaram mudanças terapêuticas, que estão de acordo com as descritas na literatura, resultando na adequação da antibioterapia e do consumo de antibióticos. Para além do referido, não se verificaram diferenças estatisticamente significativas entre os doentes submetidos às diferentes atitudes terapêuticas, no que diz respeito à mortalidade na UCI ou duração do internamento.
A rentabilidade microbiológica obtida no LBA foi de 29,2%. Uma meta-análise de estudos randomizados19 documentou uma positividade microbiológica nos doentes submetidos às técnicas invasivas superior, que variou entre 44,1 e 68,9%. Contudo, nestes estudos, para além da duração média da VMI prévia à randomização ter sido inferior, entre os 6 e 11 dias comparada com 13 dias no presente estudo (valor mediano coincidente com o valor médio), também a percentagem de doentes com prescrição prévia de antibióticos foi consideravelmente inferior, entre 50,4 e 78,2% versus 100% nos nossos doentes. Estas diferenças decorrem provavelmente do facto de que atendendo a questões relacionadas com a racionalização de recursos, no nosso ambiente, as BFC com LBA são efectuadas maioritariamente na PAV tardia em doentes com sinais de deterioração clínica, ausência de resposta apesar da terapêutica empírica ou imunocomprometidos, o que pode explicar a elevada percentagem de uso prévio de antibióticos ou impossibilidade de suspensão, e, portanto, a maior probabilidade de resultados falsos negativos7.
Os microorganismos isolados no LBA coadunam-se com aqueles previstos neste tipo de pneumonia nosocomial tardia20,21. Segundo Trouillet, a classificação da PAV em quarto grupos de acordo com a duração da VMI e a presença ou ausência de antibioterapia prévia pode ser uma estratégia útil para a selecção da terapêutica antibiótica a instituir20. A relevância é colocada na necessidade de cobertura antibiótica de microorganismos potencialmente multirresistentes, como P. aeruginosa, A. baumannii, S. maltophilia e SAMR, particularmente implicados nas pneumonias do grupo 4 (>7 dias de VMI e com antibioterapia prévia), como foi o caso das incluídas no nosso estudo, em que se constatou o isolamento destes agentes em 56,3%.
Após conhecimento do resultado cultural do LBA verificou-se alteração da atitude terapêutica em 38,0% dos casos, valor que está em conformidade com o descrito na meta – análise anteriormente citada (27,0 a 41,7%)19.
Para além do referido, e embora não tenha sido encontrada uma diferença significativa, a utilização das culturas quantitativas do LBA parece influenciar a prescrição, que foi mais frequente na presença de contagens de UFC/ml >104 (48,5% versus 28,9%). De notar que foram igualmente efectuadas alterações terapêuticas com cargas bacterianas abaixo do limite de 104 (15,8%), baseando-nos no entendimento que o estado de imunossupressão do doente e até a carga antibiótica prévia devem ser considerados na interpretação das culturas quantitativas7.
Na maioria dos casos a terapêutica antimicrobiana instituída foi a adequada. A inapropriação foi responsável por mudança na antibioterapia em 16,9%. Ps. aeruginosa (57,1%) foi o agente mais frequentemente responsável por resistência aos antimicrobianos. Por outro lado, espécies de Candida e Aspergillus spp. (60,0%) considerados patogénicos dado o seu isolamento em contextos de imunossupressão, estiveram mais frequentemente implicados nas situações em que se verificou ausência de um antimicrobiano dirigido ao agente infeccioso.
A descalação ocorreu em 12,7%, tanto com a redução do número de antibióticos, como com a redução do espectro antimicrobiano. Contudo, a descalação pode igualmente ocorrer com a redução da duração e com a descontinuação da antibioterapia. No caso de culturas negativas e evolução clínica favorável, a descontinuação da antibioterapia reveste-se de particular importância22, principalmente na presença de bacilos Gram negativos não fermentadores onde um resultado cultural negativo é particularmente significativo, mesmo sob antibioterapia ou modificação recente de antibióticos, pois a persistência daqueles agentes é frequente e a sua erradicação é difícil e lenta7. De realçar, contudo, que como o resultado das culturas negativas não foi analisado, é de supor uma sob estimativa na verdadeira percentagem de descalação, o que constitui uma limitação a apontar.
É igualmente importante denotar a existência de dados na literatura documentando que a descalação ocorre mais frequentemente quando são utilizadas culturas quantitativas das técnicas invasivas14,17 em oposição às não invasivas, enquanto outros contradizem estes resultados23. Em contrapartida, parece existir concordância na documentação de que a descalação ocorre mais frequentemente após a implementação de protocolos de antibioterapia baseados nas recomendações internacionais e nos padrões epidemiológicos locais24. Apesar do referido, a presença de uma elevada percentagem de infecções múltiplas pode condicionar a possibilidade de descalação, como ocorreu nos doentes em que se verificou manutenção da atitude terapêutica, onde a descalação baseada no resultado das culturas quantitativas teria sido possível apenas numa pequena percentagem de casos (9,1%).
Finalmente, foi encontrada uma menor mortalidade global e uma menor duração do internamento na UCI nos doentes em que a atitude terapêutica foi mantida corroborando que « right at first time » pode estar associada com um melhor prognóstico. Por outro lado, a mortalidade atribuída à PAV foi menor no grupo em que a terapêutica foi alterada/ajustada, e, embora a duração do internamento neste grupo tenha sido superior, esta foi claramente influenciada pelo valor obtido nos doentes em que foi iniciada antibioterapia dirigida. Para além do referido, e embora o numero reduzido da amostra em cada grupo/subgrupo imponha sérias limitações quanto à analise dos outcomes, a ausência de uma diferença estatística entre os doentes submetidos às diferentes atitudes terapêuticas, podem estar de acordo com alguns dados da literatura indicando que embora as técnicas invasivas possam conduzir a alterações na prescrição, estas poderão não ter impacto nos outcomes19.
O impacto do uso do LBA em comparação com o uso de técnicas não invasivas só poderá ser inferido mediante um outro tipo de estudo, nomeadamente um estudo randomizado.
Conflito de interesseOs autores declaram não haver conflito de interesse.