Como é sabido, nos doentes com infeção por vírus da imunodeficiência humana (VIH) existe um alto risco de ocorrência de infeções oportunistas (IO), tais como as infeções por Pneumocystis jirovecii, um agente patogénico com distribuição mundial, que provoca pneumonia intersticial (PPc). Apresentamos um caso de um doente recém-diagnosticado com infeção por VIH-1 e múltiplas IO pulmonares, incluindo uma forma persistente de PPc, aspergilose invasiva (AI), e infeções por citomegalovírus e por Mycobacterium xenopi. Descrevemos a combinação de fatores cruciais para a recuperação do doente, que incluíram a obtenção de dados laboratoriais, intervenção cirúrgica e múltipla terapêutica antimicrobiana.
It is well established that HIV patients are at high risk of opportunistic infections (OI), like the ones caused by Pneumocystis jirovecii, a worldwide pathogen implicated in interstitial pneumonia (PcP). We present a case of a newly diagnosed HIV-1 patient with multiple OI, including a persistent form of PcP, an invasive aspergillosis (IA), cytomegalovirus and Mycobacterium xenopi lung infection. We describe the combination of laboratorial screening, surgery and antimicrobial therapy that were crucial for patient recovery.
Um homem com 59 anos de idade, previamente saudável, apresentava uma história de 4 meses de evolução de fraqueza progressiva, disfagia, perda de apetite, emagrecimento e tosse ocasional com emissão de secreções purulentas. Em novembro de 2007, foi internado com quadro de dispneia aguda. Apresentava febre (38,0°C), sinais de candidíase orofaríngea e crepitações inspiratórias na auscultação de ambos os hemitórax. Nos exames complementares, encontrou-se uma insuficiência respiratória parcial (pO2 66mmHg, pCO2 34mmHg), e a radiografia do tórax revelou uma acentuada nodularidade bilateral intersticial difusa. A pesquisa de anticorpos anti-VIH-1 (ELISA) foi positiva. Um diagnóstico clínico de candidíase oral e esofágica, e de pneumonia intersticial (PPc), foram assumidas. Foi iniciada antibioterapia com cotrimoxazol (1 960mg qid), prednisolona (40mg bid) e fluconazol (200mg qd).
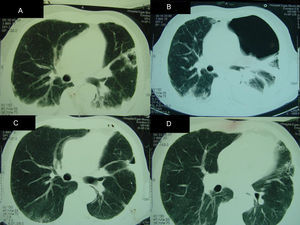
A endoscopia digestiva alta confirmou o diagnóstico de candidíase esofágica. Passadas 2 semanas, suspendeu-se o tratamento com fluconazol, e após 21 d de tratamento com cotrimoxazol, este foi ajustado para 960mg qd, e a prednisolona reduzida para 10mg qd. A avaliação laboratorial do sangue periférico revelou uma contagem de linfócitos T CD4+ de 21 células/μl (5%) e uma carga viral de VIH-1 de 307 285 cópias/ml. Foi observada melhoria clínica parcial com o tratamento instituído, persistindo a febre. À quarta semana de internamento, foi realizada uma tomografia computadorizada (TC) do tórax, que revelou uma condensação bilateral alveolar com derrame pleural, e uma cavidade com sinal do halo, no pulmão esquerdo (fig. 1). O doente foi submetido a broncofibroscopia com colheita de lavado broncoalveolar (LBA 1). Foi observada uma alta carga de quistos de Pneumocystis jirovecii (4-30 por campo, com ampliação x1 000), através da técnica de imunofluorescência indireta com anticorpos monoclonais (IF) (kit MonoFluo P. jirovecii, Bio-Rad, França). A presença de P. jirovecii foi confirmada por amplificação do gene que codifica para a subunidade grande do rRNA mitocondrial (mtLSU rRNA), utilizando PCR nested. No mesmo LBA, foi observado o crescimento de Aspergillus fumigatus em cultura. Após conhecimento destes resultados, a terapêutica antimicrobiana foi alterada para clindamicina (600mg qid), primaquina (30mg qd) e voriconazol (200mg após uma dose de carga). Devido à persistência da febre, foi pesquisada a presença de antigenémia pp6 do citomegalovírus (CMV), que foi positiva (248 células infetadas/50 000 leucócitos). Contudo, na fundoscopia, exame do líquido cefalorraquidiano, endoscopia digestiva alta e colonoscopia não se encontraram alterações atribuíveis ao CMV. No entanto, no LBA foi encontrado DNA de CMV por PCR, pelo que se iniciou ganciclovir (325mg b.i.d.). Foram cumpridos 26 d de clindamicina e primaquina, e 21 d de ganciclovir. Posteriormente, foram iniciadas as profilaxias com atovaquona (1 500mg qd), pirimetamina (50mg qd), e valganciclovir (900mg qd).
Achados radiológicos obtidos durante o internamento do doente. Tomografia computadorizada (TC) do tórax, demonstrando: (A) (quarta semana de internamento) condensação bilateral alveolar com derrame pleural, e aspergiloma no hemitórax esquerdo; (B) (nona semana após internamento) hidropneumotórax; (C e D) (6 meses após internamento) melhoria do derrame pleural e do hidropneumotórax. O aspergiloma foi removido durante a cirurgia.
Oito semanas após a admissão, concluíram-se 57 d de tratamento anti-Pneumocystis e 30 d de tratamento anti-Aspergillus. Foi colhido um novo LBA (LBA 2), revelando a persistência de uma alta carga parasitária de P. jirovecii (4-30 quistos por campo em ampliação x1 000) e de A. fumigatus. Detetou-se ainda a persistência de DNA de CMV nessa amostra. Dado que o doente se mantinha apirético, e que a antigenemia de CMV no sangue periférico se encontrava negativa, não foi reinstituído tratamento anti-CMV em dose terapêutica. No entanto, o doente mantinha tosse e dificuldade respiratória significativa. Realizou-se nova TAC do tórax, que evidenciou condensação alveolar e a cavidade de aspergiloma com dimensões sobreponíveis às inicialmente observadas. Foi iniciado um terceiro curso de terapêutica para PPc (com clindamicina e primaquina), e adicionou-se caspofungina (50mg uma vez ao dia, após dose de carga) ao tratamento antifúngico com voriconazol. Nessa altura, o laboratório forneceu a informação do crescimento em cultura de Mycobacterium xenopi no primeiro lavado broncoalveolar (LBA 1). Foi instituída terapia com etambutol (1200mg qd), azitromicina (500mg, qd) e levofloxacina (500mg, qd). Dada a profunda imunossupressão do doente, foi também iniciada terapia antirretroviral (ARV). Após a exclusão de HLA-B57 01, e para evitar interações, foi escolhido um esquema com abacavir (ABC, 600mg/d), lamivudina (3TC, 300mg/d) e indinavir (IDV, 800mg 3 vezes/d). Os 2 LBA colhidos durante o episódio foram caracterizados geneticamente em 5 loci de P. jirovecii, os quais codificam para mtLSU rRNA, citocromo b (CYB), superóxido dismutase (SOD), di-hidrofolato redutase (DHFR), e di-hidropteroato sintetase (DHPS), utilizando PCR seguida de sequenciação de DNA. Ambas as amostras revelaram combinações idênticas de genótipos (tabela 1).
Genótipos de Pneumocystis jirovecii detetados nas diferentes amostras estudadas
| Amostra | Locus | ||||
|---|---|---|---|---|---|
| mtLSU rRNA | CYB | SOD | DHFR | DHPS | |
| BAL 1 | Genótipo 2 | CYB 1/2a | SOD 1 | DHFR Wt | DHPS Wt |
| BAL 2 | Genótipo 2 | CYB 1/2a | SOD 1 | DHFR Wt | DHPS Wt |
| Aspergiloma | Genótipo 3 | CYB 1/2a | SOD 1 | DHFR Wt | DHPS 75 |
| Tecido pleural | Genótipos 1/3a | CYB 1/2a | SOD 1 | DHFR Wt | DHPS 75/78a |
Nomenclatura dos genótipos com base em Esteves et al. 201013.
Wt: genótipo selvagem.
Uma semana depois, o doente desenvolveu um hidropneumotórax à esquerda. Foi submetido a descorticação pleural com toracotomia, e remoção do aspergiloma (fig. 1). No tecido removido, continuaram a ser identificados P. jirovecii e A. fumigatus. Duas mutações, nos codões 75 e 78 do gene DHPS de P. jirovecii, foram detetadas pela primeira vez (GenBank: números de acesso GU479992, GU479993), verificando-se a presença de uma treonina em vez de uma isoleucina na posição 75da proteína, e de uma prolina em vez de uma leucina na posição 78. Os resultados da genotipagem de P. jirovecii no tecido pleural e nas secções de aspergiloma estão resumidos na tabela 1.
Desde a realização da cirurgia, o doente apresentou uma melhoria gradual e sustentada. Teve alta 16 semanas após a admissão. No total, completou 77 d de terapia para a PPc (21 d de cotrimoxazol e 56 d de curso de clindamicina e primaquina); 22 d de ganciclovir; 9 meses de voriconazol (com 71 d de caspofungina), e 15 meses de tratamento antibacilar. A ARV foi posteriormente simplificada, substituindo-se indinavir por efavirenze. Vinte meses após a alta, o doente recuperou o seu estilo de vida, apresentando carga viral de VIH-1 indetetável e 350 linfócitos TCD4+/μL (11%).
DiscussãoA PPc mantém-se como uma infeção oportunista (IO) definidora de SIDA frequente na Europa e nos Estados Unidos1. É considerada um fenómeno fisiopatológico complexo que pode envolver outras coinfeções bacterianas, fúngicas ou virais. No entanto, poucas publicações descreveram previamente coinfeções envolvendo P. jirovecii, Aspergillus, micobactérias e CMV. No global, as coinfeções na PcP relacionam-se com um pior desfecho clínico2–5.
A aspergilose invasiva (AI) é uma IO rara em doentes com infeção por VIH, sendo mais frequente em indivíduos com neoplasia e neutropenia. A apresentação subaguda da AI, aqui descrita, corresponde a uma forma denominada de aspergilose necrotizante crónica. Aparece tipicamente em doentes moderadamente imunodeprimidos (como diabéticos e/ou doentes sob corticoterapia crónica em dose baixa), e doença estrutural do pulmão6.
Dois dos fatores mais importantes na patogénese do Aspergillus são baseados na disfunção do epitélio pulmonar do hospedeiro (uma barreira física, bioquímica e imunitária ao Aspergillus) e na presença de resíduos de ácido siálico na superfície dos conídios, que se ligam com alta afinidade ao fibrinogénio e ao epitélio respiratório. Na PPc, a lesão do epitélio alveolar, acumulação de material tipo surfactante, expressão de fibrinogénio e deposição de fibrina são característicos7,8. A combinação de infeção por VIH, corticoterapia e lesão epitelial pulmonar produzida por P. jirovecii poderão ter contribuído para o desenvolvimento da AI. De facto, a associação destas 2 entidades em doentes com infeção por VIH foi previamente sugerida noutros relatos de casos clínicos, e num pequeno estudo retrospetivo3.
Os fatores de risco reconhecidos para falência do tratamento ou profilaxia de PPc são a existência de um episódio prévio de PPc, contagem de linfócitos TCD4+ inferior a 50 células/μl e a utilização de um regime antibiótico sem cotrimoxazol9. Vários polimorfismos em diferentes loci de P. jirovecii estão potencialmente relacionados com falência antimicrobiana, especificamente mutações reconhecidas nos codões 55 e 57da DHPS, relacionadas com a resistência a fármacos da família das sulfas. Neste caso, essas mutações não foram observadas; no entanto, novas mutações pontuais nos codões 75 e 78 foram encontradas e descritas. A persistência de P. jirovecii após terapia com cotrimoxazol sugere, mas não prova, que a mudança observada nesses 2 resíduos poderá ter, de alguma forma, afetado a atividade enzimática da DHPS10,11. Mais estudos são necessários para investigar essa relação.
Foi também detetada uma substituição de fenilalanina por leucina no codão 280 do CYB. As mutações no CYB estão associadas à exposição à atovaquona, e tem sido sugerido que mutações pontuais encontradas na região Qo (um dos 2 locais de ligação da coenzima Q do citocromo b) poderão estar relacionadas com insucesso da profilaxia com atovaquona. Uma vez que o aminoácido 280 não está envolvido na ligação da coenzima Q ou da atovaquona, esta mutação deve-se provavelmente à variação genotípica, e não a uma mutação relacionada com falência da profilaxia com atovaquona12,13.
Genótipos específicos de P. jirovecii poderão estar associados a resultados distintos de episódios de PPc. Em estudos anteriores, altas cargas parasitárias foram detetadas com maior frequência em amostras com a combinação mtLSU rRNA genótipos 2/3, SOD 1 e DHFR genótipo selvagem; a combinação mtLSU rRNA genótipos 2/3 e SOD 1 foi mais frequente em amostras de doentes com pior desfecho clínico14,15. Os genótipos encontrados neste caso poderão sugerir infeção por P. jirovecii com variantes mais patogénicas (rRNA mtLSU genótipos 2/3, SOD 1 e DHFR genótipo selvagem).
Após 9 semanas de terapia anti-PPc, foi detetada uma alta carga de quistos de P. jirovecii no interior do aspergiloma. Fatores como o pH local, a temperatura e a presença de fibrose circunjacente à cavidade de aspergiloma poderão ter afetado a penetração de antibióticos, o que poderá ter conduzido a uma eventual seleção de mutações de resistência. Componentes produzidas por A. fumigatus, como a gliotoxina, um potente imunossupressor de ação local, e elastases, que provocam a lise dos tecidos circundantes8, poderão também ter contribuído para a adesão e persistência de P. jirovecii nos tecidos.
Embora tenha sido observada uma resposta clínica ao voriconazol, foi com a cirurgia que se observou uma melhoria clínica mais marcada, talvez pela diminuição da carga infecciosa e pela erradicação de um possível «santuário» biológico que contribuiu, muito provavelmente, para o desenvolvimento e multiplicação de P. jirovecii e Aspergillus, bem como para a cooperação entre esses 2 microrganismos.
O significado clínico e a patogenicidade de M. xenopi e de CMV no pulmão são ainda controversos. A American Thoracic Society (ATS) declara que M. xenopi pode atuar como patógenio, principalmente em pessoas com doença pulmonar prévia. Apresenta-se mais frequentemente através de uma cavidade pulmonar, mas, em doentes com infeção por VIH, poderá ocorrer doença disseminada. Este agente é por vezes implicado apenas como um colonizador do organismo humano e como contaminante de água utilizada em dispositivos médicos e equipamentos de laboratório, sendo responsável por pseudossurtos. Os critérios da ATS para doença associada a micobactérias atípicas implicam a exclusão de outras causas possíveis, a presença de sintomas pulmonares e uma confirmação microbiológica fiável, como o crescimento em cultura de LBA16. No presente caso, foi assumido que o doente apresentava fatores de risco significativos e cumpria os critérios de infeção. De forma idêntica, foi anteriormente reportado um caso de infeção pulmonar por M. xenopi e Aspergillus, num doente com infeção por VIH e infeção prévia por P. jirovecii3.
O significado clínico da deteção de CMV em amostras respiratórias permanece controverso em doentes com infeção por VIH, ao contrário do que ocorre em doentes transplantados, em que o seu papel se encontra bastante mais estabelecido17. Dados importantes sobre esta questão provêm de estudos em autópsias. Um desses estudos demonstrou que, em 75 indivíduos que faleceram com infeção por VIH, metade deles com insuficiência respiratória, 44 (59%) tinham evidência histológica de infeção por CMV. Em mais de metade dos doentes, os investigadores admitiram que o CMV teria pouca ou nenhuma implicação na disfunção pulmonar daqueles doentes. No entanto, em 21 desses 44 doentes, os investigadores admitiram que o CMV poderia ter algum papel patogénico18. O CMV é frequentemente identificado em pulmões de doentes com pneumonia grave e, no contexto de infeção por VIH, na PPc. Noutro estudo, realizado em 111 doentes com SIDA e um primeiro episódio de PPc, 53 (48%) demonstraram a presença de CMV no LBA. Não se verificou diferença, entre doentes com resultado positivo e negativo para CMV, em termos da apresentação inicial, sobrevivência a longo prazo, mortalidade intra-hospitalar, ou tempo de hospitalização19.
Não obstante os papéis destes 2 microrganismos e a sua melhor abordagem, neste contexto, serem assuntos ainda discutíveis, optou-se por iniciar terapêutica antimicobacteriana e antiviral, dada a presença, na altura, de sintomatologia e de uma evolução clínica desfavorável.
Em conclusão, apresentamos um caso de um doente recém-diagnosticado com infeção por VIH-1 e diagnósticos de PPc persistente, AI e infeções pulmonares prováveis causadas por M. xenopi e CMV. Detetámos perfis associados a um genótipo mais virulento de P. jirovecii, e 2 novas mutações pontuais no gene DHPS de P. jirovecii foram descritas pela primeira vez. A variação genética de P. jirovecii no mesmo hospedeiro e em diferentes partes do tecido pulmonar confirmou que esta infeção poderá ser policlonal. Apesar da atual disponibilidade de múltiplos fármacos antibacterianos, antifúngicos e antivirais, gostaríamos de assinalar esta combinação de fatores, que demonstrou ser um desafio à abordagem das IO associadas ao VIH.
Responsabilidades éticasProteção dos seres humanos e animaisOs autores declaram que os procedimentos seguidos estavam de acordo com os regulamentos estabelecidos pelos responsáveis da Comissão de Investigação Clínica e Ética e de acordo com os da Associação Médica Mundial e da Declaração de Helsínquia.
Confidencialidade dos dadosOs autores declaram ter seguido os protocolos de seu centro de trabalho acerca da publicação dos dados de pacientes e que todos os pacientes incluídos no estudo receberam informações suficientes e deram o seu consentimento informado por escrito para participar nesse estudo.
Direito à privacidade e consentimento escritoOs autores declaram ter recebido consentimento escrito dos pacientes e/ou sujeitos mencionados no artigo. O autor para correspondência deve estar na posse deste documento.
Conflito de interessesOs autores declaram não haver conflito de interesses.