O enfisema pulmonar apresenta como principal característica a obstrução do fluxo aéreo resultante da destruição das paredes alveolares distais ao bronquíolo terminal. As abordagens terapêuticas clínicas existentes têm contribuído para o prolongamento e melhora na qualidade de vida dos portadores de enfisema. Porém, até o momento nenhum tratamento clínico existente tem sido capaz de alterar o curso da doença e resultar em cura do doente. As diferentes estratégias terapêuticas têm como objetivo o aumento da sobrevida e/ou a melhora na qualidade de vida dos doentes com enfisema pulmonar. Neste contexto, a terapia celular apresenta‐se como uma alternativa terapêutica promissora, com grande potencial de aplicabilidade em doenças degenerativas do pulmão. Nesta proposta de protocolo, todos os pacientes serão submetidos a testes laboratoriais, como a avaliação das funções cardíaca e pulmonar e exames de rotina. A colheita das células‐tronco será realizada por meio de 10 punções em cada crista ilíaca, totalizando um volume final de 200mL de medula óssea coletada. Após a preparação, separação, contagem e marcação (opcional) das células mononucleares, os pacientes receberão uma infusão intravenosa de uma suspensão de Células Mononucleares da Medula Óssea (CMMO). Pretende‐se, neste artigo, a proposta de um protocolo de terapia celular racional e seguro com potencial para o desenvolvimento de novos projetos, que sirva como referencial metodológico para a formulação de protocolos de aplicação clínica relacionados ao uso de terapia celular para a DPOC. O protocolo proposto neste artigo foi submetido e aprovado pelo Comitê Nacional de Ética em Pesquisa (Conep ‐ Brasil) registado como o número 14.764. Também está registado no Clinical Trials.gov (NCT01110252).
The main feature of pulmonary emphysema is airflow obstruction resulting from the destruction of the alveolar walls distal to the terminal bronchioles. Existing clinical approaches have improved and extended the quality of life of emphysema patients. However, no treatment currently exists that can change the disease course and cure the patient. The different therapeutic approaches that are available aim to increase survival and/or enhance the quality of life of emphysema patients. In this context, cell therapy is a promising therapeutic approach with great potential for degenerative pulmonary diseases. In this protocol proposition, all patients will be submitted to laboratory tests, such as evaluation of heart and lung function and routine examinations. Stem cells will be harvested by means of 10 punctures on each anterior iliac crest, collecting a total volume of 200mL bone marrow. After preparation, separation, counting and labeling (optional) of the mononuclear cells, the patients will receive an intravenous infusion from the pool of Bone Marrow Mononuclear Cells (BMMC). This article proposes a rational and safe clinical cellular therapy protocol which has the potential for developing new projects and can serve as a methodological reference for formulating clinical application protocols related to the use of cellular therapy in COPD. This study protocol was submitted and approved by the Brazilian National Committee of Ethics in Research (CONEP – Brazil) registration number 14764. It is also registered in ClinicalTrials.gov (NCT01110252).
Estados patológicos pulmonares caracterizados por limitação progressiva, não reversível, ao fluxo aéreo são reunidos sob a designação geral de doença pulmonar obstrutiva crônica (DPOC)1–3. Dentro do espectro da DPOC existem 2 entidades nosológicas: bronquite crônica e enfisema. Bronquite crônica é caracterizada por fibrose, estreitamentos luminais, resistência aumentada e inflamação das vias aéreas. O enfisema pulmonar, por sua vez, apresenta como principal característica a destruição das paredes alveolares distais ao bronquíolo terminal, sem fibrose pulmonar significativa1–6.
O tratamento da DPOC e do enfisema inclui broncodilatadores de curta e longa duração, β‐agonistas, anticolinérgicos, xantinas, corticosteroides, mucolíticos e antibióticos. Outras medidas de suporte clínico compreendem terapias de reabilitação, oxigenoterapia e ventilação mecânica. Avanços resultantes da introdução de novas abordagens de tratamento clínico‐farmacológico têm contribuído significativamente para o prolongamento e melhora na qualidade de vida dos portadores de enfisema. Não há, porém, nenhum tratamento clínico eficaz ou curativo. O tratamento cirúrgico, como transplante de pulmão, apresenta‐se como opção terapêutica teoricamente efetiva, porém, é um procedimento de alto risco e envolve atos cirúrgicos complexos, sendo também severamente impactado pela escassez de doadores1–8.
A terapia celular com células‐tronco adultas (CTA) apresenta‐se, neste contexto, pouco explorada e estudada, mas com grande potencial de aplicabilidade em doenças degenerativas pulmonares. Diversos trabalhos em modelos animais têm mostrado que células‐tronco adultas (hematopoéticas e mesenquimais) podem migrar para áreas lesadas e promover regeneração morfológica e/ou funcional do parênquima pulmonar9–12.
Objetiva‐se, com este artigo, a proposição de um protocolo clínico de terapia celular com células mononucleares da medula óssea (CMMO). Espera‐se que esta nova abordagem metodológica possa, de forma racional e segura, balizar a elaboração de novos projetos e servir como referencial metodológico para a formulação de protocolos de aplicação clínica, resultantes do emprego de terapia celular em DPOC.
O protocolo proposto neste artigo refere‐se ao projeto registado no ClinicalTrials.gov (NCT01110252) e ao de registo número 14.764 no Comitê de Ética em Pesquisa (Conep – Brasil).
Métodos/desenho experimentalEste estudo corresponde a um ensaio clínico de fase I (avaliação da segurança do procedimento) com contribuição metodológica e operacional da Universidade Estadual Paulista – Unesp (Assis, SP, Brasil). Os participantes receberão informações escritas e verbais explicando o estudo e um consentimento por escrito será obtido de todos os participantes antes do início do procedimento.
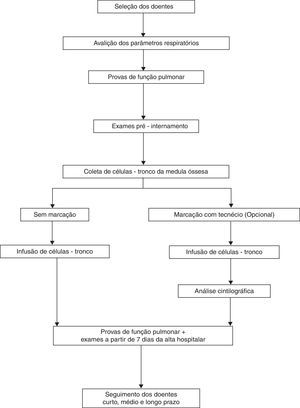
O desenho do protocolo foi baseado em estudos prévios que indicam que o procedimento para coleta, separação e infusão de CMMO é um procedimento virtualmente isento de efeitos colaterais11–17. Os critérios de seleção foram definidos considerando‐se que, apesar de os pacientes estarem em um estado avançado de DPOC, apresentem um quadro clínico, laboratorial e psicológico aceitável (como função cardíaca, estado nutricional, perfil psicossocial e emocional e apoio da família) (fig. 1).
Seleção dos doentesCritérios de inclusãoPara ser incluído no protocolo, o doente deve apresentar: 1) idade entre 40‐70 anos; 2) doença pulmonar obstrutiva severa; 3) limitação nas atividades físicas diárias, pontuação na escala score de dispneia maior que 3 e outros sintomas apesar do tratamento clínico; 4) limitada expectativa de vida; 5) ter passado pelo processo de reabilitação fisioterápica pulmonar; 6) aceitável condição nutricional; 7) função cardíaca aceitável; 8) abandono do vício tabágico há, no mínimo, 6 meses; 9) satisfatório perfil psicossocial e emocional e suporte familiar; e 10) capacidade de assinar termo de consentimento escrito.
Escala score de dispneiaEscala escore de dispneia, segundo as recomendações do Conselho Britânico de Pesquisas Médicas Modificada (Modified Medical Research Council Dyspnea Scale – MRC)18,19.
- 1.
Ausência de dispneia, exceto durante exercícios extremos.
- 2.
Dispneia ao caminhar depressa no plano e/ou ao subir ladeira suave.
- 3.
Andar mais devagar que uma pessoa da mesma idade no plano devido à dispneia ou ter que parar quando andar no próprio passo no plano.
- 4.
Interromper a marcha para respirar após caminhar uma quadra (90‐120m) ou após caminhar poucos minutos em plano.
- 5.
Dispneia limita a saída de casa ou dispneia ao vestir‐se/despir‐se.
Os participantes deverão ser excluídos caso apresentem: 1) infecção pulmonar ou extrapulmonar ativa; 2) grave coronariopatia e/ou grave disfunção ventricular; 3) significativa doença renal e ou hepática, incluindo hepatite B e C; 4) doenças imunossupressoras detectadas, incluindo‐se HIV; 5) hábito tabágico; 6) neoplasias conhecidas; 7) gestação ou probabilidade de gestação; 8) não obediência ao protocolo médico estabelecido; 9) problemas psicossociais e abuso de drogas ou álcool; 10) não aceitação familiar.
Avaliação clínica e exames complementares na fase pré‐procedimentoOs doentes serão inicialmente submetidos a uma avaliação da função pulmonar completa com broncodilatador. Esta avaliação incluirá exame clínico, espirometria antes e após inalação de broncodilatador salbutamol + ipratrópio para máxima reversibilidade e mensuração do volume pulmonar e expiratório, especialmente o volume expiratório forçado em um segundo (Forced Expiratory Volume – FEV1), capacidade vital (Vital Capacity – VC), capacidade vital forçada (Forced Vital Capacity – FVC) e as razões FEV1/VC e FEV1/FVC. Capacidade pulmonar total, volume residual, capacidade de difusão pulmonar e gasometria arterial serão determinados e será realizado raio‐x de tórax. Avaliação cardíaca, incluindo ECG, ecocardiograma e teste de exercício cardiopulmonar serão igualmente realizados. Análises posteriores incluirão tomografia computadorizada do tórax (helicoidal/alta resolução), cintigrafia (inalação/perfusão). Outros exames de rotina como hemograma completo (CBC), coagulograma, ureia, enzimas hepáticas, perfil hepático e ósseo, glicemia de jejum, creatinina, proteína C‐reativa (PCR), bem como sorologias para hepatite B e C, anti‐HIV e teste treponema para a sífilis (FTA‐ABS) serão executados.
Coleta e preparo das células‐tronco da medula ósseaOs doentes serão posicionados em decúbito lateral esquerdo e mantidos com oxigênio por cateter (2L/min). A monitorização durante a coleta incluirá oximetria de pulso, pressão arterial e eletrocardiograma. Anestesia local com lidocaína 2% será infundida na região lombar sem vasoconstritor. O kit de coleta e filtração da medula óssea (Baxter Healthcare CorporationTM, Valencia, Califórnia, Estados Unidos) será utilizado, juntamente com 2,5mL de heparina (heparina sódica 500UI/mL, RocheTM, Rio de Janeiro, Rio de Janeiro, Brasil) para cada 200mL (volume final de medula óssea coletada). A coleta será realizada com uma agulha Jamshidi (PharmaceuticalTM, Baxter Healthcare Corporation, Valencia, Califórnia, EUA) por meio de 10 punções em cada crista ilíaca anterior. A medula óssea será aspirada de forma que a pressão negativa criada remova uma maior quantidade de células‐tronco hematopoiéticas. O material coletado será colocado na bolsa de coleta e submetido a uma suave homogeneização. As braçadeiras do kit serão abertas e a medula filtrada por gravidade. Uma amostra de 3mL será assepticamente separada para realização da hemocultura, viabilidade celular e pesquisa de anticorpos (CD34 e 133). As braçadeiras serão fechadas e um volume de 40mL de solução salina (0,9%) será adicionado à bolsa de coleta de forma a lavar o volume residual da bolsa e filtros, bem como diluir a medula coletada para facilitar a separação celular. As braçadeiras serão novamente abertas para que a salina e sedimentos da bolsa de coleta sejam filtrados.
Separação das células‐troncoDentro de um fluxo laminar, alíquotas de 20mL de Ficoll‐Hypaque PremiumTM (GE Healthcare, Uppsala, Suécia) serão separadas em tubos de centrífuga de 50mL (polypropileno‐CorningTM, São Paulo, São Paulo, Brasil) e então 30mL da medula óssea (diluída 1:1 com solução salina) serão cuidadosamente adicionados a cada tubo, perfazendo um volume total de 50mL por tubo. Subsequentemente os tubos serão centrifugados a 300g por 30 minutos a 18°C.
O anel de células mononucleares, formado acima da camada de Ficoll, será coletado com uma pipeta Pasteur estéril. Em seguida, as células mononucleares serão transferidas para outros tubos de 50mL. O volume será completado com meio de cultura RPMI (CutilabTM, Campinas, São Paulo, Brasil). Os tubos serão centrifugados a 300g por 15 minutos a 18°C.
Após a centrifugação, o sobrenadante será descartado. O precipitado será ressuspendido em meio de cultura RPMI. O conteúdo de todos os tubos será agregado e então centrifugado a 300g e 18°C por 10 minutos. O precipitado será diluído em 30mL de salina com 5% de albumina a centrifugado a 300g e 18°C por 30 minutos. Antes deste procedimento as células deverão ser contadas em câmara de Neubauer com solução de Turk e Trypan Blue (Chemistry DynamicsTM, São Paulo, São Paulo, Brasil) a fim de se estimar a viabilidade celular. Ao fim da centrifugação, o precipitado será ressuspendido para um volume final de aproximadamente 30mL com salina albuminada observando‐se 2 parâmetros: volume (30mL) e concentração final (1x108 células mononucleares – CMMO/mL). O volume total será filtrado utilizando‐se filtro Cell Strainer (BD FalconTM, San Jose, Califórnia, EUA) com poros de 100μm para remover qualquer impureza.
Duas contagens com solução de Turk e Trypan Blue serão realizadas: a primeira após a coleta da medula óssea e a segunda após o processamento das células. Amostras de 5,0mL da medula processada serão removidas para determinação da viabilidade celular, imunofenotipagem por citometria de fluxo, realização de hemocultura e marcação com Hexametilpropilenoamina Oxima (HMPAOTM + 99mTc).
Infusão das células‐troncoNeste protocolo, as células mononucleares da medula óssea (CMMO) serão infundidas em veia periférica, preferencialmente a veia braquial média ou outro acesso venoso de mesmo calibre. A infusão será feita após a preparação, separação, contagem e marcação (opcional) das células mononucleares. A infusão deve ser processada de forma lenta, administrando‐se 30mL da solução contendo as CMMO em uma concentração de 1x108 células mononucleares – CMMO/mL durante, aproximadamente, 20 minutos.
Marcação das células‐tronco com tecnécio (99mTc‐HMPAO®) – opcionalÉ proposta a utilização de células marcadas com tecnécio HMPAO (GE HealthcareTM; Buckinghamshire, Reino Unido) como uma forma alternativa de validar a migração de CMMO para o pulmão. Para uma marcação ótima, a metodologia proposta pelo fabricante deve ser seguida.
Análise cintilográfica/mapeamento medicina nuclearCaso o tecnécio HMPAO seja usado, então o mapeamento por medicina nuclear deverá ser feito. Com este método, leituras cintilográficas do tórax anterior e posterior podem ser feitas 10 minutos a uma hora após a infusão das células mononucleares marcadas. Uma imagem de corpo inteiro também deverá ser obtida para examinar a proporção de células retidas no pulmão em relação à contagem no corpo todo. Antes do procedimento, os pacientes devem ser submetidos a ventilação basal e estudo de perfusão.
Evolução clínica e seguimento dos pacientesApós a alta hospitalar, é imprescindível que o paciente retorne para seguimento ambulatorial. Sugere‐se, em relação à data do procedimento, o seguinte esquema de consultas e seguimento clínico‐ambulatorial: Visita 1‐7 dias, Visita 2‐1 mês, Visita 3‐ 2 meses, Visita 4‐3 meses, Visita 5‐6 meses, Visita 6‐12 meses.
A programação temporal de retornos para avaliação clínica e exames laboratoriais está sintetizada na tabela 1.
Avaliação clínica e exames complementares após o procedimento
| Parâmetros clínicos e laboratoriais | Execução em relação à data do procedimento | |||||
|---|---|---|---|---|---|---|
| 7 dias | 1 mês | 2 meses | 3 meses | 6 meses | 12 meses | |
| Visita de avaliação clínica | X | X | X | X | X | X |
| Prova ventilatória completa com broncodilatador | X | X | X | X | X | |
| RX de tórax | X | X | X | |||
| Tomografia computadorizada – tórax | X | |||||
| Cintilografia inalação/perfusão | X | |||||
| Gasometria arterial | X | X | X | |||
| Hemograma completo | X | X | X | X | X | X |
| CEA – marcador tumoral | X | |||||
| Teste de caminhada 6 minutos (teste cardiopulmonar I) | X | X | X | X | X | |
| Escala score de dispneia | X | X | X | X | X | X |
Uma série de estudos utilizando tratamento com células‐tronco em modelos animais de doenças pulmonares, como DPOC, fibrose, bem como terapia celular em pacientes com diferentes doenças tem sido publicados9–17.
Em nosso laboratório, um estudo foi conduzido utilizando‐se células‐tronco adultas em camundongos com DPOC experimentalmente induzida. Os resultados permitiram observar, de forma qualitativa e quantitativa, regeneração do tecido pulmonar em animais com enfisema e tratados com CMMO. Neste trabalho anterior foi avaliada a presença no tecido pulmonar de 2 metaloproteinases (MMP9 e MMP12), que têm um importante papel no processo inflamatório9. Os autores observaram que os animais expostos à elastase apresentaram expressão aumentada das 2 metaloproteinases no parênquima pulmonar quando comparados ao controle, evidenciando o papel da inflamação na patogênese do enfisema e o papel das CMMO, mais especificamente das células‐tronco mesenquimais, na modulação do processo inflamatório9.
Vários aspectos relativos aos procedimentos da terapia celular também tem sido objeto de discussão, tais como otimização do processo, seleção e mínima manipulação das células, terapia autóloga versus alogênica, escolha da melhor via de infusão e aplicação do número apropriado de células, bem como a quantidade e natureza das células infundidas presentes no tecido acometido e o mecanismo de ação destas células no tecido pulmonar, como proposto por Agostini, em 201021. Além disso, tem sido objeto de discussão a participação da CMMO tanto no processo de regeneração quanto na própria patogênese da DPOC, conforme discutido por Caramori et al., em 201220.
Apesar de uma série de questões pendentes quanto aos procedimentos metodológicos e mecanismos de ação, em um estudo anterior observamos que os camundongos expostos à elastase e submetidos à infusão de CMMO apresentaram uma evidente melhoria quanto aos aspectos morfológicos e concentração diminuída de metaloproteinases no tecido pulmonar9. De modo geral, estes dados indicam que a terapia celular com CMMO melhora a condição da DPOC4,9,11 modulando a inflamação, como também previamente discutido por Tzouvelekis et al., em 201322.
Em paralelo a estes resultados verificou‐se o quimerismo pulmonar em pacientes submetidos ao transplante alogênico de medula óssea23,24. É também proposto que a microvascularização do tecido pulmonar atue como uma barreira para onde células administradas por via intravenosa são preferencialmente atraídas, onde ficam retidas23,24 e ainda que a inflamação crônica no pulmão produza moléculas que sinalizem e recrutem células‐tronco (endógenas e transplantadas) com potencial para remodelação do parênquima pulmonar25. Os resultados destes estudos fornecem embasamento experimental sinalizando a possibilidade de aplicação da terapia celular em pacientes e sustentam a hipótese de que células‐tronco poderiam ser utilizadas no tratamento da DPOC26.
O protocolo proposto neste artigo refere‐se ao projeto submetido à Comissão Nacional de Ética em Pesquisa – CONEP – Registro N.°14.764 e registado no ClinicalTrials.gov (NCT01110252). A proposição original enviada à CONEP referia‐se à execução de um protocolo clínico, com perfil de um estudo clínico com finalidade principal de avaliar a segurança do emprego da terapia celular com CMMO em pacientes com DPOC em grau avançado. Trata‐se, portanto, de um protocolo clínico de fase I.
O procedimento mostrou‐se bastante seguro. Foi aplicado experimentalmente em 4 doentes e não houve registo de complicações em nenhum dos voluntários. Os resultados parciais, baseados em uma amostra pequena de apenas 4 doentes, indicam que a terapia celular com CMMO é segura e virtualmente livre de efeitos colaterais significativos.
Outro aspecto deste projeto a ser revisto refere‐se ao emprego do Granulocyte Colony‐Stimulating Factor (G‐CSF). Como bem documentado na literatura, essa droga induz à proliferação e mobilização de células hematopoiéticas27–31 e tem sido amplamente utilizada em terapia celular em modelos experimentais e pacientes humanos32–37. No protocolo original estava contemplado o emprego de G‐CSF, com uma dose diária (5mcg/Kg) durante 3 dias consecutivos, imediatamente anteriores à punção de medula e infusão das CMMO. A justificativa para o uso de G‐CSF neste estudo estava vinculada aos resultados prévios mostrando que essa droga determina, na medula óssea, um aumento de células progenitoras mieloides38 e células CD34+25. Além disso, vários outros protocolos, com destaque para o amplo estudo de terapia celular em cardiologia, que se desenvolve no Brasil, com patrocínio do Ministério da Saúde, não incluíram o emprego de G‐CSF (EMRTCC. In: http://terapiacelular.hcl.gov.br/protocolos/cardiomiopatias.php). No entanto, não há um consenso sobre uma possível vantagem do emprego de G‐CSF quando se adota a metodologia de obtenção de células por punção direta da medula óssea39. Destarte, o emprego de G‐CSF pode ser eliminado quando a punção direta da medula óssea é adotada.
Resultados relacionados à terapia celular em doentes com DPOC foram publicados pioneiramente na literatura científica pelo nosso grupo. Além do nosso grupo de pesquisa, 2 outros protocolos clínicos com terapia celular em DPOC estão registrados no Clinical Trials. Os estudos estão sob responsabilidade da Osiris Therapeutics Inc. (NTC 00683722), já completos, com resultados recentemente publicados12, e Leiden University Medical Center (NTC01306513). Nossos resultados referentes à terapia celular com CMMO permitiram observar que o procedimento é seguro, bem como livre de efeitos colaterais em pacientes com enfisema pulmonar avançado. Ainda, uma melhora da qualidade de vida foi relatada pelos pacientes tratados e foram mantidos e/ou tiveram uma discreta melhora dos parâmetros espirométricos11.
Resultados recentes, financiados pela Osiris Therapeutics Inc (Columbia, Maryland, EUA) e publicados por Weiss et al. (2012), mostraram uma redução significativa dos níveis de proteína C‐reativa um mês após o transplante de células‐tronco mesenquimais, isoladas da medula óssea e cultivadas in vitro, em pacientes com enfisema pulmonar. Não foi observada nenhuma melhora na função pulmonar ou qualidade de vida dos pacientes tratados com células‐tronco mesenquimais, denominadas e registradas como Prochymal® pela Osiris Therapeutics Inc12.
No entanto, nós propomos que as CMMO, um grande painel de células progenitoras com a presença de linhagens endoteliais, hematopoiéticas e mesenquimais poderiam, portanto, colaborar para a redução da inflamação e melhora da função pulmonar, talvez por meio da redução da proteína C‐reativa e/ou outras proteínas inflamatórias sistêmicas. Todos estes resultados e possibilidades embasam e sustentam a proposta deste protocolo de terapia celular possa ser empregado em outros centros de pesquisa. Como enfatizado por Tzouvelekis et al. (2011), estudos randomizados multicêntricos tornam‐se necessários a fim de se estabelecer importantes questões relacionadas à segurança e eficácia da terapia celular com células‐tronco adultas em doenças pulmonares26.
Em concordância com os diferentes aspectos discutidos neste artigo, a proposta deste protocolo visa estabelecer um procedimento clínico seguro para o emprego de CMMO no tratamento de pacientes com doença pulmonar obstrutiva crônica e, como descrito anteriormente, para maximizar as condições de segurança do procedimento. Ainda, é um objetivo deste estudo que o protocolo aqui discutido possa permitir o desenho de estudos subsequentes para avaliar não somente as condições de segurança, mas também a eficácia desta nova metodologia.
Responsabilidades éticasProteção de pessoas e animaisOs autores declaram que para esta investigação não se realizaram experiências em seres humanos e/ou animais.
Confidencialidade dos dadosOs autores declaram que não aparecem dados de pacientes neste artigo.
Direito à privacidade e consentimento escritoOs autores declaram que não aparecem dados de pacientes neste artigo.
FinanciamentoA Fundação para o Desenvolvimentoda Unesp (Fundunesp), Prefeitura Municipal de Assis (SP, Brasil) e CIVAP/Saúde prestaram apoio financeiro. As autoras M. Marcelino e T. Stessuk foram financiadas pela CAPES (Coordenação de Aperfeiçoamento de Pessoal de Nível Superior). A autora C. Faria foi financiada pelo Conselho Nacional de Desenvolvimento Científico e Tecnológico (CNPq).
Conflito de interessesA Fundação para o Desenvolvimentoda Unesp (Fundunesp), Prefeitura Municipal de Assis (SP, Brasil) e CIVAP/Saúde prestaram apoio financeiro. As autoras M. Marcelino e T. Stessuk foram financiadas pela CAPES (Coordenação de Aperfeiçoamento de Pessoal de Nível Superior). A autora C. Faria foi financiada pelo Conselho Nacional de Desenvolvimento Científico e Tecnológico (CNPq).
Os autores agradecem a Fundação para o Desenvolvimento da Unesp (Fundunesp), Prefeitura Municipal de Assis (SP, Brasil) e CIVAP/Saúde pelo apoio financeiro. As autoras Monica Y. Marcelino e Talita Stessuk foram financiadas pela CAPES (Coordenação de Aperfeiçoamento de Pessoal de Nível Superior). A autora C. Faria foi financiada pelo Conselho Nacional de Desenvolvimento Científico e Tecnológico (CNPq).